Origen de los vocablos científico-técnicos
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 7,8 KB
español con un tamaño de 7,8 KB
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 7,8 KB
español con un tamaño de 7,8 KB
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 1,58 KB
español con un tamaño de 1,58 KB
Teoría cinético-molecular de los gases perfectos:
-Un gas está formado por moléculas infinitamente pequeñas que no ocupan volumen en relación al volumen disponible por el gas.
-Estas moléculas se mueven al azar en cualquier dirección y con trayectorias rectilíneas hasta que chocan, ocasionando presion
-Sus choques son elásticos, sin pérdida de energía para el gas.
-Las moléculas del gas son independientes unas de otras.
- La energía cinética media de las moléculas depende de la temperatura.
-La presión depende del número de moles, n, porque si hay más moléculas, habrá más choques.
-A mayor temperatura, mayor presión, pues las moléculas se mueven más rápidamente y los choques serán más frecuentes y más fuertes.
-A menor... Continuar leyendo "Gases húmedos" »
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 4,38 KB
español con un tamaño de 4,38 KB
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 1,84 KB
español con un tamaño de 1,84 KB
| Sólidos | g/cm3 | kg/m3 |
|---|---|---|
| Aluminio | 2,7 | 2.700 |
| Corcho | 0,25 | 250 |
| Cobre | 8,96 | 8.960 |
| Hielo | 0,92 | 920 |
| Hierro | 7,9 | 7.900 |
| Madera | 0,2-0,8 | 200-800 |
| Plomo | 11,3 | 11.300 |
| Vidrio | 3,0-3,6 | 3.000-3.600 |
| Líquidos | g/cm3 | kg/m3 |
| Acetona | 0,79 | 790 |
| Aceite | 0,92 | 920 |
| Agua de mar | 1.025 | 1.025 |
| Agua destilada | 1 | 1.000 |
| Alcohol etílico | 0,79 | 790 |
| Gasolina | 0,68 | 680 |
| Leche | 1,03 | 1.030 |
| Mercurio | 13,6 | 13.600 |
| Gases (0 °C, 1 atm) | g/cm3 | kg/m3 |
| Aire | 0,0013 | 1,3 |
| Butano | 0,0026 | 2,6 |
| Dióxido de carbono | 0,0018 | 1,8 |
| Hidrógeno | 0,0008 | 0,8 |
| Oxígeno | 0,0014 | 1,4 |
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 1,66 KB
español con un tamaño de 1,66 KB
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 1,25 KB
español con un tamaño de 1,25 KB
La molalidad (m) es el número de moles de soluto por kilogramode solvente. Para preparar soluciones de una determinada molalidad enun disolvente, no se emplea un matraz aforado como en el caso de lamolaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
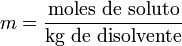
La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión,cuando éstas cambian, el volumen cambia con ellas. Gracias a que lamolalidad no está en función del volumen, es independiente de latemperatura y la presión, y puede medirse con mayor precisión.
Es menos empleada que la... Continuar leyendo "Molalidad" »
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 3,43 KB
español con un tamaño de 3,43 KB
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 5,51 KB
español con un tamaño de 5,51 KB
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 5,37 KB
español con un tamaño de 5,37 KB
PROCESOS DE TOSTACIÓN
Tostación de acción instantánea: Se efectúa en una modificación del tostador convencional de hogar múltiple. Se puede dar al concentrado con contenido de 30% de S una tostación oxidante y producir un óxido de zinc con menos de 1% de S.
La torta húmeda, producto del proceso precedente de beneficio, se seca primero haciéndola pasar por uno o dos hogares de secado, por los cuales se hacen pasar gases calientes provenientes de la operación de tostación. Estos hogares de secado pueden estar ya sea arriba o debajo de la cámara de tostación, dependiendo del diseño del tostador.
Ya secado, el concentrado se rastrilla hacia la periferia del hogar inferior de secado y desliza para caer a una boca de alimentación de