Variables Termodinámicas y Principios de la Termodinámica
Enviado por Chuletator online y clasificado en Francés
Escrito el en  español con un tamaño de 4,3 KB
español con un tamaño de 4,3 KB
Variables Termodinámicas y Transformaciones
Las variables termodinámicas o variables de estado son las magnitudes que se emplean para describir el estado de un sistema termodinámico. Un sistema termodinámico puede describir una serie de transformaciones que lo lleven desde un cierto estado inicial (en el que el sistema se encuentra a una cierta presión, volumen y temperatura) a un estado final en que, en general, las variables termodinámicas tendrán un valor diferente.
- Reversible: es un proceso que, una vez que ha tenido lugar, puede ser invertido (recorrido en sentido contrario) sin causar cambios ni en el sistema ni en sus alrededores.
- Irreversible: es un proceso que no es reversible. Los estados intermedios de la transformación no son de equilibrio.
Primer Principio de la Termodinámica
Primer Principio de la Termodinámica: Un sistema termodinámico puede intercambiar energía con su entorno en forma de trabajo y de calor, y acumula energía en forma de energía interna. La relación entre estas tres magnitudes viene dada por el principio de conservación de la energía.

Luego la expresión final queda:

Este enunciado del principio de conservación de la energía aplicado a sistemas termodinámicos se conoce como Primer Principio de la Termodinámica.
Entalpía
La entalpía es una magnitud termodinámica, simbolizada con la letra H mayúscula, cuya variación expresa una medida de la cantidad de energía absorbida o cedida por un sistema termodinámico, es decir, la cantidad de energía que un sistema puede intercambiar con su entorno.
La entalpía es una función de estado: AH = EHproductos – EHreactivos
Según el signo de DH las reacciones se clasifican en:
Exotérmicas: åHproductos < åHreactivos ðDH < 0. Se desprende energía.
Endotérmica: åHproductos > åHreactivos ðDH > 0. Se absorbe energía.
La entalpía de formación de un compuesto químico es la variación de entalpía de la reacción de formación de dicho compuesto a partir de las especies elementales que lo componen, en su forma más abundante.
La entalpía de reacción, que representa la variación de energía de la reacción, es la energía intercambiada en forma de calor con el entorno cuando se produce una reacción a presión constante. Se mide en 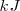 o en
o en 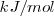 de la reacción tal como está escrita su ecuación química, o respecto a alguno de los compuestos que intervienen en la reacción.
de la reacción tal como está escrita su ecuación química, o respecto a alguno de los compuestos que intervienen en la reacción.
La ley de Hess establece que: «si una serie de reactivos reaccionan para dar una serie de productos, el calor de reacción liberado o absorbido es independiente de si la reacción se lleva a cabo en una, dos o más etapas», esto es, que los cambios de entalpía son aditivos: ΔHneta = ΣΔHr.
