Prioridad de Grupos Funcionales y Reacciones Orgánicas Clave
Enviado por Programa Chuletas y clasificado en Química
Escrito el en  español con un tamaño de 11,81 KB
español con un tamaño de 11,81 KB
| Orden prioridad | Grupo funcional | Prefijo | Sufijo(F.principal) |
|---|---|---|---|
| 1. Ácidos carboxílicos |  | Carboxi- | Ácido -oico |
| 2. Anhídridos de ácido |  | Anhídrido de ...(nombre del ácido o ácidos) | |
| 3. Ésteres | 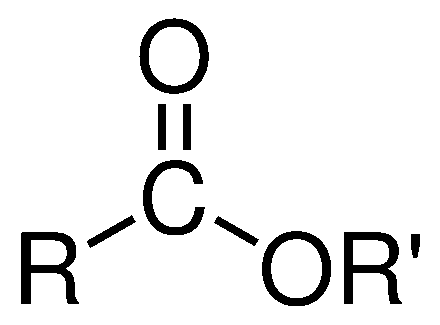 | -iloxicarbonil- | -ato de -ilo |
| 4. Haluros de Ácidos |  | Haloformil- | Haluro de -ilo |
| 5. Amidas |
| Carbamoil- | -amida |
| 6. Nitrilos |  | Ciano- | -Nitrilo o cianuro de -ilo |
| 7. Aldehídos |  | oxo- | -al |
| 8. Cetonas |  | oxo- | -ona |
| 9. Alcoholes | R-OH | Hidroxi- | -ol |
| 10. Aminas |
| Amino- | -amina |
| 11. Éteres | -O- | -oxi- | -eter- |
| 12. Alquenos |
| -enilo | -eno |
| 13. Alquinos |  | -inilo | -ino |
| 14. Derivados halogenados | R-X | fluor, cloro, bromo... | haluro de -ilo |
| 15. Nitroderivados |
| nitro- | nitro- |
| 16. Alcanos |
| -il/-ilo | -ano |
Isomería
ISOMERÍA ÓPTICA: Son compuestos orgánicos que poseen la misma fórmula molecular y solo se diferencian en que uno de los isómeros desvía el plano de vibración de la luz polarizada hacia la izquierda (isómero levógiro) y el otro hacia la derecha (isómero dextrógiro). Se caracteriza por tener un carbono asimétrico o quiral (carbono con hibridación
-geometría tetraédrica- unido a cuatro sustituyentes diferentes).
ISOMERÍA GEOMÉTRICA O CIS-TRANS: Los compuestos que incluyen enlaces que no tienen libertad de giro, como los dobles o los enlaces sencillos de un ciclo, y cada uno de los carbonos de ese enlace debe tener dos sustituyentes distintos. Se denomina cis al que presenta los sustituyentes similares en el mismo lado de ese enlace, y trans al que los presenta en la posición opuesta.
Reglas y Conceptos Clave
REGLA DE MARKOVNIKOV: Establece que al adicionarse un haluro de H a un doble enlace, el H se adiciona preferentemente al carbono con más hidrógenos.
Hibridación
HIBRIDACIÓN SP: Estos orbitales híbridos 2s se solapan frontalmente dando lugar a un enlace σ. El solapamiento lateral de los dos orbitales atómicos 2p, que quedan libres en cada carbono, da lugar a dos enlaces π. Por tanto, un enlace σ y dos enlaces π entre carbonos da lugar al enlace covalente triple entre los átomos de carbono.
HIBRIDACIÓN
: Estos orbitales SP2 se solapan frontalmente dando un enlace σ. El solapamiento lateral del orbital atómico 2p que queda libre en cada carbono da lugar a un enlace π. Por tanto, un enlace σ y un enlace π entre carbonos da lugar al enlace covalente doble.
HIBRIDACIÓN
: El orbital 2s y los tres orbitales 2p del C se hibridan para dar cuatro orbitales híbridos SP3, con geometría tetraédrica. Se forman enlaces σ entre los orbitales sp3 del C.
Reacciones Orgánicas
REACCIONES ORGÁNICAS.
-R: de adición: (de H2, de X2, de HX) a dobles y triples enlaces.

-R. de combustión

-R. de condensación.
-R. de óxido-reducción.
*ALCOHOL PRIMARIO
Oxidación. Alcohol primario -> aldehído -> ácido carboxílico.
Reducción. Ácido carboxílico -> Aldehído -> Alcohol primario.
*ALCOHOL SECUNDARIO
Oxidación. Alcohol secundario -> Cetona -> alcohol terciario.
Reducción. Cetona -> alcohol secundario.
-R. de eliminación.


