Interacció de la Radiació Infraroja amb Molècules: Espectres i Propietats
Enviado por Chuletator online y clasificado en Química
Escrito el en  catalán con un tamaño de 8,39 KB
catalán con un tamaño de 8,39 KB
TEMA 7
RADIACIÓ INFRAROJA: fem interaccionar una molècula amb una radiació electromagnètica de l'IR. Obtenim un espectre on es representa la transmissió en front del nombre d'ona. En absorbir IR, la molècula experimenta canvis en l'energia vibracional degut a la deformació dels enllaços per tensió i flexió. Això provoca un salt del nivell fonamental a un nivell excitat. Així provoca els pics.
X: representa el nombre d'ona.
Y: transmissió.
E = h·J
c = λ·J
E = h·c/λ
J = λ · c
Absorbència: Indica quin % de radiació IR ha absorbit la molècula.
Transmissió: Indica quin % de radiació IR ha deixat passar la molècula. = 1 deixa passar tota la radiació.
1 metre = 106 μm
1 metre = 100 cm
1 metre = 109 nm
PIC BASE: indica el fragment majoritari de la substància incògnita analitzada i és el pic més alt de la gràfica.
IÓ MOLECULAR: representa la molècula sense fragmentar però amb càrrega positiva. Té un valor més elevat i ens indica la massa molecular de la substància original.
X: relació massa càrrega de cada ió.
Y: abundància relativa de cada ió generat.
RESSONÀNCIA MAGNÈTICA
Els pics són deguts als diferents hidrogens en les molècules.
TEMA 8
| De cadena | Canvia l’ordre de la cadena carbonada. | Butà vs. isobutà |
| De posició | Canvia la posició d’un grup funcional o enllaç múltiple. | 1-butanol vs. 2-butanol |
| De funció | Diferents grups funcionals amb la mateixa fórmula molecular. | Alcohol → èter Aldehid → Cetona |
| Geomètrica (cis/trans) | Alquens amb substituents diferents a cada costat del doble enllaç. | Cis-butè vs. trans-butè |
| Òptica (quiralitat) | Molècules amb carboni quiral (4 substituents diferents). |
| Addició | Un compost insaturat (amb C=C o C≡C) afegeix àtoms o grups. | CH2=CH2 + HCl → CH3–CH2Cl |
| Eliminació | Es perd una molècula petita (com H2O o HX), generant una insaturació. | Alcohol → alquè + H2O |
| Substitució | Un àtom o grup és substituït per un altre. | CH3–Br + OH3 → CH3–OH + Br3 |
| Condensació | Unió de molècules amb pèrdua d’una molècula petita (H2O o HCl). | Àcid + alcohol → èster + H2O |
| Quiral | Molècula que no és superposable amb la seva imatge especular. |
| Enantiòmers | Isòmers quirals que són imatge especular un de l’altre. |
| Alquè | R–CH=CH–R' | Alquè (acaba en –è) | Butè (CH3–CH=CH–CH3) |
| Alquín | R–C≡C–R' | Alquín (acaba en –í) | Etí (CH≡CH) |
| Alcohol | R–OH | Acaba en –ol | Etanol (CH3CH2OH) |
| Aldehid | R–CHO | Acaba en –al | Etanal (CH3CHO) |
| Cetona | R–CO–R' | Acaba en –ona | Propanona (acetona) |
| Àcid carboxílic | R–COOH | Comença per “àcid…” | Àcid etanoic (CH3COOH) |
| Èter | R–O–R' | Nom: "alquil–alquil–èter" | Dietilèter (CH3CH2–O–CH2CH3) |
| Èster | R–COO–R' | Acaba en –at d’alquil | Acetat d’etil (CH3COOCH2CH3) |
| Amina | R–NH2 (primària) | Acaba en –amina | Etilamina |
| Amida | R–CONH2 | Acaba en –amida | Etanamida (acetamida) |
| Addició | Monòmers amb doble enllaç (C=C). | Polietilè (HDPE), PVC, PS | ❌ No |
| Condensació | Monòmers amb grups funcionals reactius (–OH, –COOH, –NH2). | PET, Niló-6,6 | ✅ Aigua (H2O) o altres |
Àcid + alcohol → èster + H2O
Àcid + amina → amida + H2O
TEMA 9
Radi atòmic: Distància entre el nucli i l’últim electró.
AUMENTA ↓ a una columna, ← en un període.
Electronegativitat
Mesura la força d'atracció que exerceix un àtom sobre els electrons d'un altre àtom en un enllaç químic.
AUMENTA ↑ cap a la dreta i cap amunt de la taula periòdica.
Energia de Ionització
Energia necessària per arrencar un electró d’un àtom en estat gasós i en estat fonamental.
↑ a la dreta, ↑ cap amunt.
La segona energia d’ionització d’un element és l’energia que cal subministrar a un ió atòmic monopositiu (en estat gasós) per arrencar-hi un electró. Així, pel magnesi tenim: Mg(g) → Mg+ (g) + 1 e- (primera energia d’ionització) Mg+ (g) → Mg2+ (g) + 1 e- (segona energia d’ionització).
El catiò Mg+ té un excés de càrrega positiva (protons) en relació a la càrrega negativa (electrons); això fa que el nucli atreu amb més força els electrons i, per tant, el radi del Mg+ és més petit que el del Mg.
+ ELECTRONS La força d’atracció sobre els electrons és menor i les repulsions entre ells augmenten; això fa que els electrons es separin i el radi augmenti.
Tenen l’electró més extern en l’orbital s, però el liti a la capa 2 i el potassi a la capa 3. Com més gran sigui la capa, el radi atòmic és més alt.
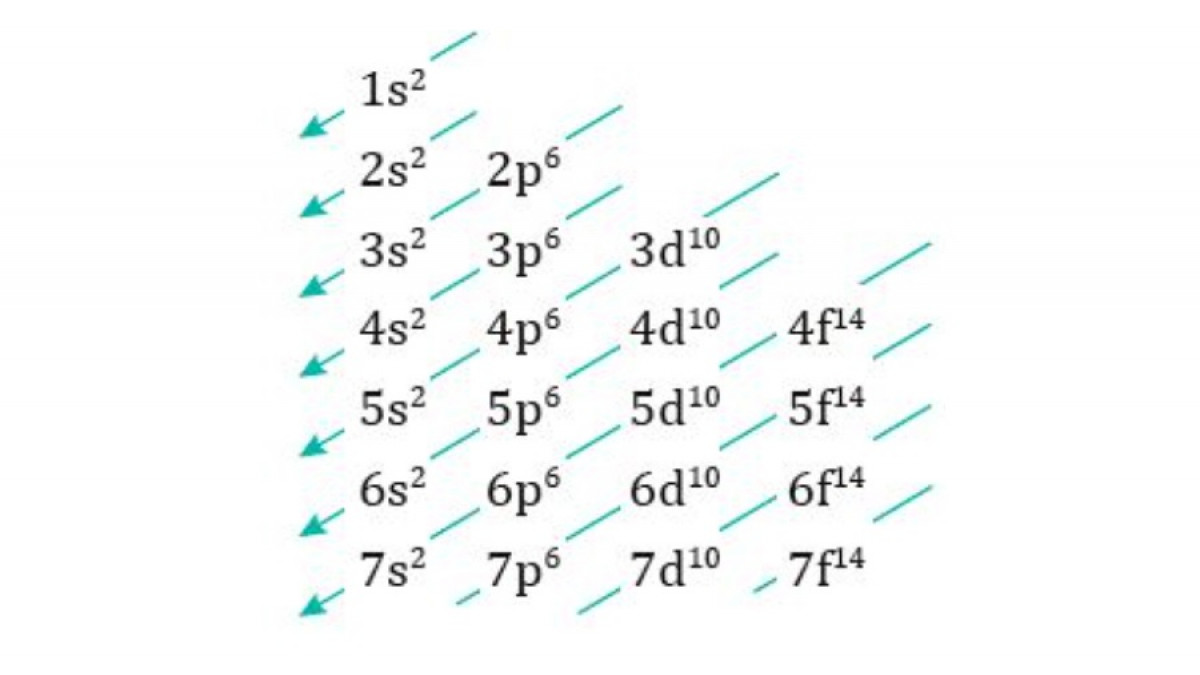
Afinitat electrònica
Energia alliberada quan un àtom neutre guanya un electró en estat gasós.
Orbital atòmic: és una funció d’ona que ens descriu una regió de l’espai on hi ha una alta probabilitat de trobar un electró en un determinat estat energètic.
Tot i que els tres elements tenen l’electró més extern en la mateixa capa (n=3), el sofre té més protons i electrons que el magnesi i això provoca que l’atracció de les càrregues positives (nucli) amb les negatives (electrons) sigui més gran en el sofre i el radi sigui, per tant, més petit.
