Fundamentos de la Estructura Atómica y la Tabla Periódica
Enviado por Chuletator online y clasificado en Química
Escrito el en  español con un tamaño de 5,29 KB
español con un tamaño de 5,29 KB
Postulados de Bohr
Primer postulado: Los electrones se mueven en ciertas órbitas permitidas alrededor del núcleo sin emitir radiación. Así Bohr asumió que el átomo de hidrógeno puede existir solo en ciertos estados discretos, los cuales son denominados estados estacionarios del átomo.
Segundo postulado: El átomo radia cuando el electrón hace una transición (“salto”) desde un estado estacionario a otro, es decir, toda emisión o absorción de radiación entre un sistema atómico está generada por la transición entre dos estados estacionarios.
Tercer postulado: Las órbitas estacionarias admisibles son aquellas en las que el momento angular orbital 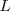 del electrón está cuantizado, pudiendo este asumir solamente valores múltiplos enteros de
del electrón está cuantizado, pudiendo este asumir solamente valores múltiplos enteros de 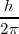 .
.
La Tabla Periódica de los Elementos
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas.
Modelo Mecánico Cuántico
Erwin Schrödinger propuso el modelo mecánico cuántico del átomo, el cual trata a los electrones como ondas de materia.
Partículas Subatómicas
| Modelo | Año | Descubridor | Símbolo | Carga o Unidad |
|---|---|---|---|---|
| ELECTRÓN | 1897 | Thomson | e- | -1 |
| PROTÓN | 1886 | Goldstein | p+ | +1 |
| NEUTRÓN | 1932 | Chadwick | n0 | 0 |
Número Atómico y Masa Atómica
Número atómico: Número de protones que hay en el núcleo del átomo de un elemento.
- 17 partículas subatómicas
- Bosón, Positrón, Electrón, Protón, Fermión, Neutrino, Hadrón, Neutrón
- Leptón, Quark, Mesón
Metales y No Metales
Los no metales varían mucho en su apariencia, no son lustrosos y por lo general son malos conductores del calor y la electricidad. Corresponden a los elementos situados a la izquierda y centro de la Tabla Periódica (Grupos 1 (excepto hidrógeno) al 12, y en los siguientes se sigue una línea quebrada que, aproximadamente, pasa por encima de Aluminio (Grupo 13), Germanio (Grupo 14), Antimonio (Grupo 15) y Polonio (Grupo 16).
Modelos Atómicos de Rutherford y Thomson
Modelo atómico de Rutherford:1 Es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford2 en 1911, para explicar los resultados de su «experimento de la lámina de oro».
Modelo atómico de Thomson: Es una teoría sobre la estructura atómica propuesta en 1904 por Thomson, quien descubrió el electrón1 en 1897, pocos años antes del descubrimiento del protón y del neutrón.
Elementos Químicos y sus Símbolos
Un elemento químico es un tipo de materia constituida por átomos de la misma clase.
- Oro: Elemento metálico
Símbolo: Au
Nº atómico: 79
Nº másico: 196.96 - Yodo: Elemento no metálico (halogenado)
Símbolo: I
Nº atómico: 53
Nº másico: 126.9045 - Cloro: No metal (halogenado)
Símbolo: Cl
Nº atómico: 17
Nº másico: 35.4527 - Plata: Elemento metálico
Símbolo: Ag
Nº atómico: 47
Nº másico: 107.868 - Flúor: No metálico (halogenado)
Símbolo: F
Nº atómico: 9
Nº másico: 18.99840 - Bromo: No metálico (halogenado)
Símbolo: Br
Nº atómico: 35
Nº másico: 79.904 - Calcio: Elemento metálico
Símbolo: Ca
Nº atómico: 20
Nº másico: 40.078 - Hierro: Elemento metálico
Símbolo: Fe
Nº atómico: 26
Nº másico: 55.847 - Molibdeno: Elemento metálico
Símbolo: Mo
Nº atómico: 42
Nº másico: 95.94
