Estructura Atómica y Tabla Periódica: Conceptos Clave
Enviado por Chuletator online y clasificado en Química
Escrito el en  español con un tamaño de 189,43 KB
español con un tamaño de 189,43 KB
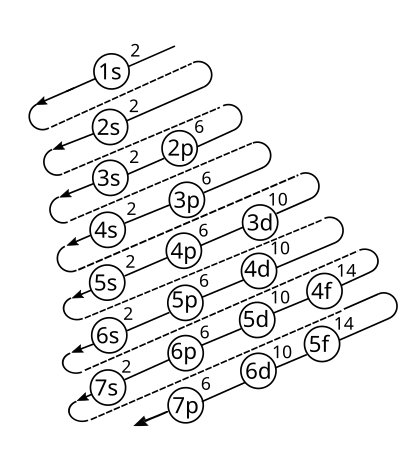
Principios de Estructura Atómica
Principio de Exclusión de Pauli
El principio de exclusión de Pauli establece que dos electrones en un átomo no pueden tener el mismo conjunto de números cuánticos. Esto significa que un electrón debe tener un spin de -½ y otro de +½.
Regla del Dueto
La regla del dueto se aplica a elementos como el helio, que buscan completar su capa de valencia con dos electrones para alcanzar la estabilidad.
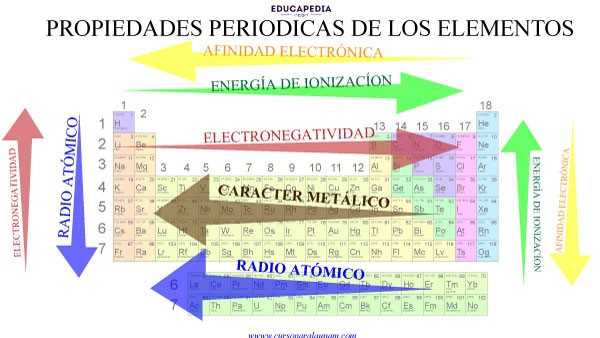
Electronegatividad
La electronegatividad es la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma un enlace químico.
Subnivel de Energía f
El subnivel de energía f puede contener un máximo de 14 electrones.
Organización de la Tabla Periódica
Períodos y Grupos
La tabla periódica tiene 7 períodos (filas horizontales) y 18 grupos o familias (columnas verticales).
Elementos Conocidos
La tabla periódica actual presenta 118 elementos conocidos.
Ubicación de Elementos
- El hidrógeno se encuentra en el grupo 1 y el período 1.
- El helio se encuentra en el grupo 18 y el período 1.
- El cloro (Z=17) se encuentra en el período 3 y el grupo 17.
- Los gases nobles se encuentran en el grupo 18.
Desarrollo Histórico
Mendeleev organizó los elementos en la tabla periódica en función de sus masas atómicas, sentando las bases para la tabla moderna.
Enlaces Químicos e Interacciones Intermoleculares
Tipos de Fuerzas Intermoleculares
- Fuerzas de Dispersión de London: Se producen entre moléculas no polares.
- Enlaces de Hidrógeno: Involucran a átomos de hidrógeno unidos a átomos electronegativos como el oxígeno.
- Interacciones Ion-Dipolo: Ocurren entre iones y moléculas polares, como la sal disuelta en agua.
- Fuerzas Dipolo-Dipolo: Se producen entre moléculas polares.
Compuestos Inorgánicos
Clasificación de Compuestos
- Anhídridos: No metal + oxígeno
- Óxidos Metálicos: Metal o metaloide + oxígeno
- Hidruros: Metal o metaloide + hidrógeno
- Ácidos Oxácidos: Anhídrido + H2O
- Hidróxidos: Óxido metálico + H2O
Nomenclatura de Compuestos
- Hidróxidos: Se nombran con la palabra "hidróxido" seguida del nombre del metal.
- Ácidos Oxácidos: La nomenclatura depende del número de oxidación del elemento central y la cantidad de átomos de oxígeno.
- Terminación -oso para el menor número de oxidación.
- Terminación -ico para el mayor número de oxidación.
- Prefijos hipo- y per- para indicar el menor y mayor número de oxidación, respectivamente.
- Prefijos meta-, piro- y orto- para indicar diferentes cantidades de átomos de oxígeno.
