Equilibri Químic: Comprensió de la Reacció i Factors Clau
Enviado por Chuletator online y clasificado en Física
Escrito el en  catalán con un tamaño de 90,85 KB
catalán con un tamaño de 90,85 KB
S'assegura l'equilibri químic quan la velocitat de la reacció directa i la velocitat de la
reacció inversa s'igualen.
L'estat d'equilibri és dinàmic; això significa que es formen tants reactius com
productes es descomponen, i a l'inrevés. Aquest fet és imperceptible
macroscòpicament, perquè sembla que res no canviï en el sistema.
La temperatura a la qual es duu a terme la reacció marca les proporcions entre els
components del sistema en equilibri. A més de la temperatura, hi ha altres factors
externs que poden modificar aquestes proporcions.
L'equació anterior és l'expressió matemàtica de la llei d'acció de masses (LAM). Aquesta llei
estableix que per a una reacció reversible en equilibri a una temperatura constant, la relació
de concentracions elevades als coeficients estequiomètrics respectius, entre reactius i
productes, té un valor constant, KC.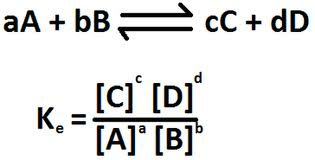
Per determinar quina direcció seguirà la reacció per arribar a l'equilibri, es comparen els
valors de QC i KC. Ens podem trobar davant de tres situacions diferents:
Si QC = KC, estem en situació d'equilibri.
Si QC ≠ KC, el sistema no està en equilibri:
Si QC < KC, la reacció va cap a la formació de productes (cap a la dreta).
Si QC > KC, significa que la concentració de productes inicial excedeix la
concentració d'equilibri; per tant, l'evolució de la reacció serà en el sentit
oposat, és a dir, cap a la formació de reactius (cap a l'esquerra).
