Conceptos Esenciales de Química: Átomos, Materia y Reacciones Fundamentales
Enviado por Chuletator online y clasificado en Química
Escrito el en  español con un tamaño de 6,68 KB
español con un tamaño de 6,68 KB
El Átomo: Conceptos Fundamentales
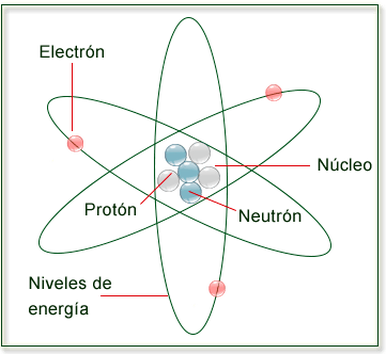
Estados de la Materia y Transiciones
La materia puede presentarse en diferentes estados, cada uno con características distintivas:
- Sólido: Partículas muy juntas y fuertemente cohesionadas. Posee forma y volumen constantes.
- Líquido: Partículas juntas pero con poca cohesión. Mantiene un volumen constante, pero no tiene forma fija, adaptándose al recipiente.
- Gaseoso: Partículas separadas y sin cohesión. No posee forma ni volumen fijo, ocupando todo el espacio disponible.
Las transiciones entre estos estados son:
- Fusión: De sólido a líquido.
- Vaporización: De líquido a gaseoso (puede ser por evaporación o ebullición).
- Condensación: De gaseoso a líquido.
- Solidificación: De líquido a sólido.
- Sublimación: De sólido a gaseoso directamente.
- Sublimación regresiva (o Deposición): De gaseoso a sólido directamente.
La Materia: Definición y Propiedades
La materia se define como todo aquello que posee masa y ocupa un volumen en el espacio.
La densidad se calcula como la relación entre la masa y el volumen (densidad = masa / volumen), y sus unidades comunes son kg/m³ o g/cm³.
Para expresar cantidades muy grandes o muy pequeñas, se utiliza la notación científica (potencias de 10, por ejemplo, 10x).
- Sustancias simples: Formadas por átomos de la misma clase (ej. O3).
- Sustancias compuestas: Formadas por átomos de distinta clase (ej. H2O).
Características de la Materia
Características Intrínsecas (Intensivas):
Estas propiedades no dependen de la cantidad de materia presente:
- Coeficiente de solubilidad: Cantidad máxima de soluto que puede disolverse en 100 ml de agua a una temperatura específica.
- Punto de fusión: Temperatura a la cual una sustancia cambia de estado sólido a líquido.
- Punto de ebullición: Temperatura a la cual un líquido pasa a estado gaseoso, variando según la presión.
- Color, sabor y olor: Propiedades organolépticas.
Características Extrínsecas (Extensivas):
Estas propiedades dependen de la cantidad de materia presente:
- Masa (m)
- Volumen (V)
- Longitud
Teorías y Leyes Fundamentales de la Química
Teoría Cinético-Molecular: Describe el comportamiento de los gases basándose en los siguientes principios:
- Los gases están formados por partículas minúsculas, separadas y en constante movimiento aleatorio, que chocan entre sí y con las paredes del recipiente.
- Los gases ocupan todo el volumen del recipiente que los contiene.
- Las partículas ejercen presión sobre las paredes del recipiente debido a sus colisiones.
- A mayor velocidad promedio de las partículas, mayor es la temperatura del gas.
Ley de Boyle: Establece que la presión de un gas en un recipiente cerrado es inversamente proporcional a su volumen, siempre que la temperatura se mantenga constante.
P₁·V₁ = P₂·V₂Ley de Charles: Con la presión constante, el volumen de un gas es directamente proporcional a su temperatura absoluta.
V₁/T₁ = V₂/T₂Ley de Gay-Lussac: La presión de un gas es directamente proporcional a su temperatura absoluta, manteniendo el volumen constante.
P₁/T₁ = P₂/T₂Ley Combinada de los Gases: Combina las leyes de Boyle, Charles y Gay-Lussac, estableciendo la relación entre presión, volumen y temperatura de un gas.
P·V = n·R·T(Ecuación de los Gases Ideales, donde n es la cantidad de sustancia en moles y R es la constante de los gases ideales)Ley de Conservación de la Masa (Lavoisier): La masa total de las sustancias reaccionantes es igual a la masa total de los productos de la reacción; la masa no se crea ni se destruye en una reacción química.
Reacciones Químicas: Síntesis
Las reacciones de síntesis (o combinación) consisten en la unión de dos o más sustancias (reactivos) para formar un único compuesto más complejo (producto).
Ejemplo: A + B → AB
Ajuste de Ecuaciones Químicas
El ajuste de ecuaciones químicas (o balanceo) es el proceso de igualar el número de átomos de cada elemento en ambos lados de una reacción química, asegurando la conservación de la masa. Se logra añadiendo coeficientes estequiométricos delante de las fórmulas de las sustancias.
Ejemplo:
H₂ + O₂ → H₂O (sin ajustar)
2H₂ + O₂ → 2H₂O (ajustada)
Concentración Molar (Molaridad)
La concentración molar (o molaridad, M) se define como la cantidad de moles de soluto disueltos en un litro de disolución.
La Tabla Periódica: Organización y Enlaces
En el sistema periódico actual, los elementos se organizan por orden creciente de su número atómico (Z), lo que resulta en una repetición periódica de sus propiedades físicas y químicas.
- Se organiza en 18 columnas (denominadas grupos) y 7 filas (denominadas períodos).
- Los grupos se clasifican de la siguiente manera:
- Grupos 1 y 2: Metales alcalinos y alcalinotérreos (metálicos).
- Grupos 3 al 12: Metales de transición.
- Grupos 13 al 17: No metales (incluyendo metaloides).
- Grupo 18: Gases nobles.
Tipos de Enlaces Químicos:
- Enlace Metálico: Se forma entre átomos de metales (Metal + Metal).
- Enlace Iónico: Se forma entre un metal y un no metal (Metal + No Metal).
- Enlace Covalente: Se forma entre átomos de no metales (No Metal + No Metal).
