El Átomo: Modelo de Thomson, Isótopos y Formación de Iones
Enviado por Chuletator online y clasificado en Química
Escrito el en  español con un tamaño de 3,73 KB
español con un tamaño de 3,73 KB
Conceptos Fundamentales de la Estructura Atómica
Modelo Atómico de Thomson
Thomson supuso que el átomo era una especie de pudín formado por una masa positiva en la que se encontraban insertados los electrones (partículas que Thomson identificó). Ciertamente, no tuvo en cuenta la existencia de protones ni de neutrones, que fueron descubiertos posteriormente.
Limitaciones del Modelo de Thomson
Según el modelo de Thomson, los átomos están constituidos por una distribución de carga y masa regular, y estos están unidos unos con otros formando la sustancia. Es decir, la sustancia debería poseer una estructura interna homogénea y, por este motivo, las partículas al atravesarlas deberían tener un comportamiento uniforme.
Luego de los experimentos de Rutherford y el descubrimiento de las partículas subatómicas, se vio que lo dicho por Thomson no se cumplía. Por otro lado, aunque Thomson explicó la formación de iones, dejó sin explicación la existencia de otras reacciones.
Isótopos
Los isótopos son átomos de un mismo elemento (una misma Z) que tienen diferente número másico (A). Es decir, átomos que tienen el mismo número de protones (Z) pero diferente número de neutrones (A = p + n cambia).
Ejemplo de Isótopos
Consideremos el átomo 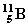 y el átomo
y el átomo 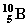 . Ambos son del mismo elemento (Boro), dado que los dos tienen número atómico 5 (número de protones del núcleo). Se diferencian en el número másico: uno de ellos tiene 11 de número másico y el otro 10. Ambos átomos del mismo elemento que se diferencian en el número másico se denominan isótopos de dicho elemento.
. Ambos son del mismo elemento (Boro), dado que los dos tienen número atómico 5 (número de protones del núcleo). Se diferencian en el número másico: uno de ellos tiene 11 de número másico y el otro 10. Ambos átomos del mismo elemento que se diferencian en el número másico se denominan isótopos de dicho elemento.
Como el número másico es la suma de protones y neutrones, tendremos:
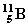 : A = p + n ; 11 = 5 + n ; n = 11 - 5 = 6 neutrones
: A = p + n ; 11 = 5 + n ; n = 11 - 5 = 6 neutrones
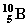 : A = p + n ; 10 = 5 + n ; n = 10 - 5 = 5 neutrones
: A = p + n ; 10 = 5 + n ; n = 10 - 5 = 5 neutrones
Por lo tanto, los isótopos del mismo elemento se diferencian en el número de neutrones.
Por último, existe un gran número de isótopos que no son estables. Se desintegrarán por procesos de decaimiento radiactivo. Los isótopos que son radiactivos se llaman radioisótopos.
Iones
Son átomos cargados (positivos o negativos). Como el núcleo es intocable con las energías que aparecen en las reacciones químicas, la única forma de que un átomo se cargue eléctricamente es quitando o poniendo electrones:
- Iones positivos, también llamados cationes, son átomos que han perdido electrones. Cada electrón que pierden es una carga positiva que queda en exceso en el núcleo.
- Iones negativos, también llamados aniones, son átomos que han ganado electrones. Cada electrón que ganan es una carga negativa en exceso sobre los protones del núcleo.
- Los átomos neutros tienen tantos protones (carga positiva) como electrones (carga negativa). Como ambas partículas tienen la misma carga pero con distinto signo, al tener la misma cantidad de ambas, el átomo es neutro. Cuando quitamos electrones, quedan más cargas positivas que negativas. Cuando añadimos electrones, tenemos más cargas negativas que positivas.
