Áreas Corticales del Cerebro: Funciones Sensoriales y Motoras
David Santamaría Buitrago
Biólogo
Est. Especialización en Neuroanatomía
El cerebro, como centro regulador de todas las funciones superiores en los seres vivos, tiene ciertas características inherentes. Sin embargo, la corteza cerebral no presenta una estructura uniforme; por ello se ha dividido, anatómica y funcionalmente, en una serie de áreas que difieren en espesor, número de células, fibras y funciones.
Una lesión o alteración en un punto específico de la corteza tendrá una connotación funcional determinada.
Áreas Sensoriales de la Corteza Cerebral
Áreas Sensoriales Primarias
Las áreas sensoriales primarias son regiones donde se proyectan los impulsos relacionados con percepciones sensoriales específicas provenientes de todo el organismo. Estos impulsos son integrados, analizados o procesados para dar una respuesta específica según el estímulo.
Algunas sensaciones primitivas ingresan a la conciencia a través del tálamo, mientras que las áreas sensoriales primarias se relacionan con la integración de experiencias sensoriales y las cualidades discriminativas de la sensación (excepto el olfato). Se clasifican según el tipo de sensación:
- Somatestésica: circunvolución postcentral y su extensión medial en el lobulillo paracentral.
- Visual o estriada: labios de la cisura calcarina.
- Auditiva: dos circunvoluciones transversas.
- Gustativa: parte inferior de la circunvolución postcentral.
- Olfatoria primaria: corteza de las regiones piriforme y periamigdalina.
Áreas Sensoriales Secundarias
Las áreas sensoriales secundarias son adyacentes a las primarias y de menor tamaño.
Área Somatestésica Primaria (SI) (áreas 3, 1, 2)
El área somatestésica primaria es responsable de la sensibilidad somática general, superficial y profunda. Se localiza en la circunvolución postcentral y la parte posterior del lobulillo paracentral.
Está compuesta por tres bandas (3, 1, 2) en la pared posterior de la cisura central: 3a en las profundidades de la cisura central y 3b en la pared posterior. Las áreas 1 y 2 forman la cima y la pared posterior de la circunvolución postcentral, respectivamente.
El área 3, 1, 2 recibe proyecciones talámicas de los núcleos ventrales posteriores, que transmiten impulsos desde el lemnisco medial, haces espinotalámicos y vías trigeminotalámicas ascendentes.
En el complejo ventrobasal del tálamo, la región central recibe impulsos cutáneos, mientras que la periferia recibe impulsos de receptores de otros tejidos.
Las proyecciones talamocorticales desde el complejo ventrobasal hasta la corteza somatestésica primaria están organizadas somatotópicamente.
La región central se proyecta hacia el área 3b (impulsos cutáneos); el área 3a recibe impulsos aferentes de los husos musculares.
Las células del núcleo ventral posterolateral se proyectan hacia las áreas 3, 1 y 2, y hacia el área somática secundaria.
Estas proyecciones corticales están organizadas topográficamente. El área somatestésica primaria (SI) y el área somática sensorial II (SS II) están conectadas recíprocamente y topográficamente en el mismo hemisferio.
Las regiones del cuerpo presentan una representación somatotópica en partes específicas de la circunvolución postcentral, con un patrón similar al del área motora. El área de la cara se encuentra en la parte inferior, seguida de las áreas de la mano, brazo, tronco, pierna y pie; la extremidad inferior está representada en el lobulillo paracentral. Las áreas corticales que representan las regiones de la mano, cara y boca son desproporcionadamente grandes. Esta representación se conoce como Homúnculo sensitivo.
Entre el surco central y el postcentral se encuentra el giro postcentral (área sensitiva primaria).
Una lesión en esta área (3, 1, 2) produce pérdida de la sensibilidad somática contralateral.
Área Somatosensorial II (SS II)
Se encuentra a lo largo del borde superior de la cisura lateral y se extiende posteriormente en el lóbulo parietal. Recibe aferencias de los núcleos talámicos ventrales posteriores, y de la corteza somatestésica primaria ipsilateral y contralateral (SI).
No presenta un mapa topográfico como la primaria. Sin embargo, la mayoría de las neuronas responden a estímulos cutáneos de manera similar a SI. Las conexiones corticales eferentes de SS II se realizan hacia el área somatestésica primaria y el área motora primaria del mismo hemisferio.
Área Visual Primaria (área 17)
El área visual primaria se localiza en las paredes y el piso de la cisura calcarina.
El haz geniculocalcarino termina en esta corteza; estas fibras, antes de llegar, pasan por el estrato sagital externo (pared externa del ventrículo lateral), provenientes del núcleo dorsal del cuerpo geniculado externo.
Como en el cuerpo geniculado externo, las diferentes porciones de la retina se organizan específicamente en el área cortical visual. Las señales de la mácula terminan en el tercio caudal de la cisura calcarina, mientras que la retina nasal y temporal lo hacen en los dos tercios anteriores. La mácula de cada ojo solo tiene representación cortical en un hemisferio.
La destrucción unilateral completa de la corteza visual produce una hemianopsia homónima contralateral (ceguera en el campo nasal y temporal contralateral).
La hemianopsia homónima contralateral puede ser consecuencia de lesiones que comprometan las fibras de la cintilla óptica o de la radiación óptica, pero las lesiones a este nivel tienden a ser incompletas y los defectos visuales raramente son idénticos en ambos ojos.
Áreas Visuales Secundarias (área 18 y 19)
Una segunda área visual rodea al área visual primaria (superficie medial y lateral del hemisferio). Recibe proyecciones del área primaria y otras áreas corticales para la integración y relación de la información con experiencias visuales previas, reconociendo aspectos previamente aprendidos.
Estas áreas también presentan una representación retinotópica.
Aunque los hemisferios carecen de muchas conexiones directas, algunas fibras comisurales interconectan la región en el límite de las áreas 17 y 18, conformando un meridiano vertical del campo visual, indispensable para un campo visual uniforme a lo largo de la línea media vertical.
Campos Oculares Corticales
Campo Ocular Frontal
Rostral al área premotora se encuentra el área responsable de los movimientos oculares voluntarios (circunvolución frontal media, área 8). La estimulación produce movimiento conjugado de los ojos y su coordinación para el mantenimiento preciso de la mirada, independientemente de los estímulos visuales.
En el giro frontal medio se encuentra el campo frontal de los ojos, importante para el movimiento conjugado.
Campo Ocular Occipital
A diferencia del campo frontal, no se encuentra en un sitio específico. El movimiento coordinado es dependiente de estímulos visuales involuntarios.
Área Auditiva Primaria (áreas 41 y 42)
El área auditiva primaria se encuentra en las dos circunvoluciones transversas de Heschl, en la cara dorsomedial de la circunvolución temporal superior, ocultas en el piso de la cisura lateral.
La parte media de esta circunvolución constituye las principales áreas receptoras auditivas (área 41), mientras que el resto y las porciones adyacentes de la circunvolución temporal superior componen el área 42 (asociación auditiva).
El área auditiva recibe fibras geniculotemporales (radiación auditiva) del cuerpo geniculado interno; esta radiación se origina en la parte laminar ventral del cuerpo geniculado interno y se proyecta a la corteza auditiva primaria (área 41), donde existe una representación espacial de las frecuencias tonales.
La radiación auditiva alcanza su proyección cortical a través de la cápsula interna.
El cuerpo geniculado interno tiene otras dos divisiones (dorsal y medial) que reciben impulsos auditivos y se proyectan ipsilateralmente a través de la radiación auditiva a las áreas que forman un cinturón cortical alrededor del área auditiva primaria (proyección del cinturón).
La organización funcional de la corteza auditiva es similar a la corteza visual y somatestésica: las células de una misma columna celular comparten propiedades funcionales.
Cada cóclea está representada bilateralmente en la corteza auditiva. Los efectos corticales de la estimulación sonora de cada oído son casi iguales. La respuesta cortical es mayor en el lado contralateral al estímulo. Si el sonido se presenta en un plano medio, la actividad cortical de ambos hemisferios es igual.
Como la audición está representada bilateralmente a nivel cortical, las lesiones unilaterales ocasionan solo sordera parcial. Las lesiones en el área 22 de Brodmann del hemisferio dominante producen sordera verbal o afasia sensorial. La audición está intacta, pero los pacientes no interpretan el significado de los sonidos.
Área Gustativa (área 43)
El área de la sensibilidad gustativa se localiza en el opérculo parietal y la corteza parainsular. Esta representación gustativa es paralela al área somatestésica de la lengua, pero está separada del área no gustativa de la língula.
Las lesiones en el opérculo parietal ocasionan pérdida de la sensibilidad gustativa.
Áreas Corticales Motoras
De todas las regiones de la corteza cerebral se originan fibras corticófugas que conducen impulsos relacionados con la función motora, la modificación del tono muscular y la actividad refleja, la modulación de las señales sensoriales y las alteraciones de la conciencia.
Las fibras corticófugas, que se originan principalmente en las capas corticales profundas, se proyectan a niveles espinales, varios núcleos del tronco del encéfalo, tálamo y neoestriado.
Se identifican tres áreas motoras principales:
- Área motora primaria (precentral).
- Área premotora.
- Área motora suplementaria.
El área motora primaria se relaciona con la actividad motora voluntaria. El área premotora (anterior a la primaria) se relaciona con la función motora voluntaria dependiente de impulsos sensoriales. El área motora suplementaria (cara medial del lóbulo frontal) participa en la programación y el planeamiento de las actividades motoras y, posiblemente, en su iniciación.
Área Motora Primaria (MI) (ÁREA 4)
El área motora primaria se localiza en la circunvolución precentral.
Es amplia en el borde superior del hemisferio, pero cerca de la circunvolución frontal inferior se limita a la pared anterior de la cisura central.
Recibe impulsos del área somatestésica primaria, del área motora suplementaria y del área 1, 2 y 5, pero no del área 3.
El haz corticoespinal (impulsos de movimientos voluntarios a neuronas motoras inferiores) se origina en esta área, con algunas fibras de las áreas 6 y la corteza parietal. Estas fibras provienen de células que utilizan glutamato o aspartato como neurotransmisor excitador.
La estimulación genera movimientos aislados en el hemicuerpo contralateral.
Aunque el haz corticoespinal no presenta una distribución somatotópica como la corteza motora, la representación motora del cuerpo es más o menos constante. Esta distribución se conoce como homúnculo motor; boca, lengua y mano presentan mayor representación cortical, mientras que la espalda y el pie tienen menor proporción.
Las lesiones de la corteza motora producen inicialmente parálisis flácida contralateral, hipotonía y arreflexia. Después reaparecen los reflejos miotáticos, respuestas de retirada ante estímulos nociceptivos, parálisis espástica, hiperreflexia osteotendinosa y atrofia por desuso.
La pérdida de movilidad es mayor en los grupos musculares distales, pero la recuperación motora suele ser más completa que con lesiones casi totales del área motora.
La diferencia con otras áreas relacionadas con el movimiento es que el movimiento producido se da a un bajo umbral. La estimulación produce el movimiento de un solo músculo o grupo de ellos en la parte contralateral del cuerpo.
Las lesiones producen parálisis espástica contralateral, relacionadas con actividades motoras finas.
Área Premotora (ÁREA 6)
Se encuentra en la convexidad lateral del hemisferio; también se conoce como área motora suplementaria. Realiza movimientos orientados sensorialmente; se activan en respuesta a estímulos visuales, auditivos y somatosensoriales relacionados con la función motora voluntaria. Se diferencia de MI por tener un umbral de excitación más alto.
El daño unilateral que no compromete el área primaria ni suplementaria no produce paresia ni alteración funcional aparente.
Área Motora Suplementaria (M II)
El área motora suplementaria se encuentra en la circunvolución frontal superior, anterior al área cuatro.
Las neuronas relacionadas con los movimientos son de tres tipos:
- Células relacionadas con los movimientos proximales.
- Células relacionadas con los movimientos distales.
- Células activas durante todo el desempeño motor.
La mayoría de las neuronas se activan independientemente del lado del cuerpo donde se presente el movimiento.
M II interviene en mecanismos que ejercen influencia sobre el tono muscular y modifican la postura, la respuesta refleja automática de prensión, la coordinación bimanual y el movimiento voluntario. Intervienen en la programación de secuencias motoras complejas adquiridas.
Las lesiones unilaterales producen pérdida temporal en la función de mantenimiento de la postura y la capacidad para realizar el movimiento; si la lesión se presenta en el área primaria, la disfunción será permanente.
Asociación Motora
Los impulsos que se originan en las áreas motoras se encargan del movimiento, el control del tono muscular y el mantenimiento de la postura.
El impulso de las actividades (voluntarias e involuntarias) es regulado por el cerebelo a través de sus conexiones con el tálamo, que funciona como unidad integradora. Recibe estímulos de otras estructuras nerviosas (receptores propioceptivos) para ser llevados a las diferentes áreas motoras según sea requerido, manteniendo la armonía en el sistema.
Referencias Bibliográficas
- Carpenter, M. (1994). Neuroanatomía, Fundamentos. Cuarta Edición. Editorial Médica Panamericana.
- Kandel, E., & Schwartz, J. (Eds.). (2004). Principios de Neurociencias. Editorial McGrawHill.
- Bustamante, J. (2001). Neuroanatomía Funcional y Clínica. Tercera Edición. Editorial Celsus.
- Snell, R. (2001). Neuroanatomía clínica. Quinta edición. Editorial Médica Panamericana.
http://www.waece.org/web_nuevo_concepto/lecturas_05_a.htm
Cerebro y Actividad Nerviosa Superior: Las Bases Neurofisiológicas de la Educación Infantil
Dr. Franklin Martínez Mendoza. Cuba
Una Introducción Necesaria
El desarrollo del niño depende de múltiples condiciones. La psicología, la fisiología y la pedagogía, entre otras ciencias, buscan esclarecerlas. El estudio del desarrollo psíquico del niño debe ir más allá de la simple descripción de sus logros y características, para establecer sus causas, factores condicionantes y el tránsito entre etapas.
En este desarrollo, es crucial determinar qué se atribuye a las estructuras y funciones biológicas dadas genéticamente y qué corresponde a las condiciones de vida y educación. Esto es fundamental para posibilitar el máximo desarrollo de las potencialidades psíquicas del individuo.
Numerosas experiencias han tratado de definir si lo biológico o lo social es lo principal en el desarrollo. Investigaciones como la de Ladiguina-Kots (con un bebé chimpancé) o los hallazgos de Rid Singh (niñas-lobas Kamala y Amala, y el caso de Ramu) permiten establecer dos conclusiones fundamentales:
- Sin un cerebro humano, no es posible el surgimiento de cualidades psíquicas humanas.
- El cerebro humano por sí mismo no determina el surgimiento de las cualidades psíquicas humanas.
El psiquismo humano no surge sin condiciones humanas de vida. Las principales tendencias actuales sobre el desarrollo psíquico coinciden en que juegan un papel importante tanto las estructuras internas (biológico-funcionales) como las condiciones externas (sociales, culturales y educativas). La divergencia radica en la valoración de cuáles son determinantes.
Históricamente, muchos teóricos han defendido posturas extremas (McDougall, Freud, Gessell, Durkheim, Watson y Skinner). Otros han asumido una postura más contemporizadora, considerando la herencia y el medio, dando origen a enfoques como:
- La teoría de la convergencia de Stern
- La concepción de la adaptación de Piaget
- El enfoque histórico-cultural de Vigotski
Este material no busca dilucidar quién tiene la razón, sino valorar la interrelación entre lo biológico y lo social en la educación del niño, y cómo el sistema nervioso central y la actividad nerviosa superior influyen en lo determinado por factores externos.
Aun asumiendo la corriente histórico-cultural (condiciones externas como determinantes), no se debe soslayar la importancia del substrato material, orgánico y fisiológico que fundamenta el fenómeno psíquico: la psiquis humana es el resultado de un órgano material, el cerebro humano, y no puede concebirse la actividad psíquica humana sin la presencia de un cerebro humano. Bajo la acción de estímulos del medio externo e interno en la corteza cerebral surgen procesos nerviosos que constituyen el mecanismo fisiológico de la formación del proceso de reflejo de la realidad.
En la educación del niño, a veces se soslaya o desconoce la influencia de los factores internos, principalmente los referentes a la actividad nerviosa superior. Esta posición antidialéctica, que tiende a ver escindidos los factores internos y externos, es tan negativa como la que polariza uno u otro extremo, y conduce a un enfoque menos científico de la labor educativa.
El Cerebro y las Funciones Psíquicas Superiores
El estudio del cerebro se caracteriza por un aserto fundamental: la anatomía total del sistema nervioso es la anatomía de las funciones intelectuales superiores. Vigotski señala que si bien la psiquis es una función del hombre como ser corporal, material, con una determinada organización física en el sistema nervioso central (particularmente la corteza cerebral), la psiquis es social por su origen y producto de la historia de la sociedad. La apropiación por el niño de la cultura humana, materializada en objetos y fenómenos espirituales, constituye la fuente del desarrollo psíquico.
El desarrollo del ser humano no está dirigido por leyes biológicas, sino por leyes histórico-sociales. Sin embargo, la propiedad psíquica no es un producto directo del cerebro, pero no puede surgir sin él, en una unidad dialéctica de lo externo y lo interno.
La forma principal de adaptación del organismo al medio es el reflejo, la respuesta del organismo a los estímulos externos a través del sistema nervioso central. Este sistema nervioso central, compuesto por las estructuras cerebrales y la médula espinal, está formado por distintas partes que cumplen diferentes funciones y constituyen el mecanismo fundamental de la regulación nerviosa.
En la medida en que una estructura cerebral está más alta, más compleja es su función y organización. Las funciones más elementales están reguladas por la médula espinal. Encima se hallan el bulbo raquídeo y el cerebelo. Luego, el cerebro medio o mesencéfalo. Las secciones más altas son los hemisferios cerebrales (ganglios subcorticales y la corteza cerebral), substrato material de las funciones psíquicas.
La idea de una localización cerebral de las funciones psíquicas predominó durante siglos. La búsqueda de un centro rector dirigió la investigación anatómica y fisiológica. De la idea de un órgano cerebral único se pasó a la búsqueda de múltiples estructuras, cada una base material de una capacidad o propiedad específica.
La Localización de las Funciones Cerebrales
Desde Hipócrates y Galeno (líquido en los ventrículos cerebrales), hasta Vesalio (fluidos en los nervios), la idea de una localización cerebral de las funciones psíquicas predominó. Meyer y Gall perfilaron las funciones psíquicas en áreas cerebrales aisladas, dando origen a la Frenología (localización somática de las propiedades y capacidades psíquicas).
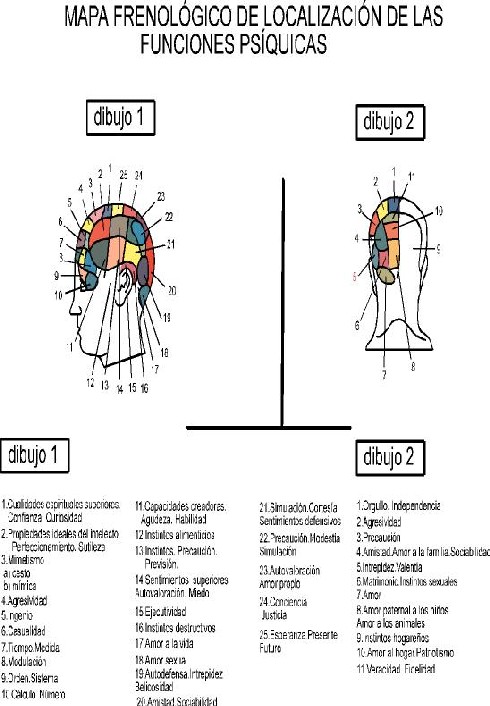
Flourens, con experimentos de ablación, destacó que la función desaparecía en el momento de la operación, pero se restablecía después, considerando que la corteza actuaba como un todo homogéneo, destacando la plasticidad de las funciones de los grandes hemisferios cerebrales.
Las teorías localizacionistas continuaron, reforzadas por los hallazgos de Broca (centro motor del lenguaje) y Wernicke (centro sensitivo del lenguaje). Se clasificaron numerosos centros (memoria visual, escritura, conceptos, ideación).
En este auge localizacionista influyeron la psicología asociacionista, la neurofisiología y la anatomía cerebral. Los experimentos de Fritsch y Hitzig (estimulación eléctrica de centros motores aislados) y los hallazgos anatómicos de Betz (células piramidales gigantes en la región motriz) reforzaron el criterio de que la corteza cerebral posee una estructura altamente diferenciada.
Los estudios de Goltz (factores dinámicos, reacción general del cerebro y plasticidad) comenzaron a perfilar la idea de la actividad del cerebro como un todo, reforzada posteriormente por Lashley y Jackson (lesión de un área específica no conduce a la desaparición completa de la función).
Monakow, Head y Goldstein contemporizaron la teoría localizacionista con el enfoque opuesto. Goldstein distinguió entre la periferia de la corteza (localización) y la parte central (equipotencial, estructuras dinámicas). El daño en la periferia afectaba los “medios” de la actividad psíquica, mientras que el daño en la parte central afectaba la actividad abstracta.
Localizacionismo y Antilocalizacionismo: Aportes y Limitaciones
El localizacionismo aportó:
- Análisis del cerebro como órgano diferenciado, con zonas específicas relacionadas con una función específica.
- El cerebro, aparentemente homogéneo, no lo era, poseyendo áreas que respondían por diferentes formas de actividad psíquica.
Los antilocalizacionistas aportaron:
- El cerebro, siendo un órgano altamente diferenciado, funciona como un todo único.
- Organización vertical de las funciones del cerebro.
Limitaciones de ambas posiciones:
- Interpretan las funciones psíquicas como fenómenos directamente relacionados con el substrato cerebral, sin considerar la etapa del análisis fisiológico.
- Superposición de conceptos inespaciales de la psicología con la construcción espacial del cerebro.
- Interpretación de los procesos psíquicos como producto o consecuencia directa de la actividad de las estructuras cerebrales.
- Reflejo de la realidad por el cerebro sustituido por el enfoque paralelista de la correspondencia entre las zonas cerebrales y las funciones psíquicas complejas.
Con los avances en la citoarquitectura cerebral (capas o estratos distintos, modalidad particular de estratificación), Vogt separó dos partes de la corteza: el isocórtex (seis capas descritas por Brodmann) y el alocórtex (estratificación incompleta o nula). Esta disposición citoarquitectónica permitió deslindar numerosos campos cuyas funciones han podido ser estudiadas. Los mapas de Brodmann reflejan la amplia diferenciación de la corteza cerebral.
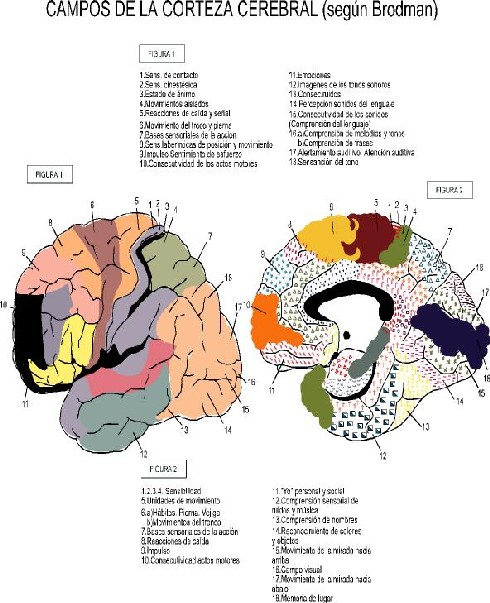
La Localización Dinámica de las Funciones Cerebrales
Pavlov sentó las bases de una “localización dinámica” de las funciones cerebrales, opuesta a las concepciones psicomorfológicas. Esto implicó la transformación del concepto de función, que de verse como una propiedad directamente relacionada con el trabajo de células altamente especializadas, comienza a enfocarse como el resultado de una actividad refleja compleja.
La función es un sistema funcional que cumple una tarea biológica (fisiológica), asegurada por un complejo grupo de actos intervinculados. Al constituir una cadena dinámica de eslabones situados en diferentes niveles del sistema nervioso, puede darse el caso de que tales eslabones cambien y la propia tarea no se inmuta, en particular los eslabones intermedios. Esto explica porqué el fallo de una determinada organización del cerebro se ve más menos compensada por el aumento de la función de otra, al darse una integración general y una unidad funcional.
No hay formación del sistema nervioso central que posea una función estrictamente limitada, y en determinadas condiciones esta formación se puede incluir en otros sistemas funcionales y participar en otras acciones. Este pluripotencialismo funcional permite que áreas aisladas de la corteza cerebral puedan incluirse en diferentes sistemas y participar de diversas funciones.
Los procesos mentales superiores no son un producto de la actividad directa del cerebro, sino una actividad refleja compleja mediante la cual se realiza el reflejo de la realidad.
Los Mecanismos Reflejos de las Funciones Nerviosas
La base fisiológica del reflejo de la realidad la constituye el arco reflejo (receptor, vía aferente, cadena de neuronas, vía eferente, efector). El reflejo es la forma fundamental de adaptación del organismo al medio.
Los reflejos pueden ser incondicionados (innatos, presentes al nacimiento) y condicionados (formados en el curso de la vida, mediados por la corteza cerebral).
Los reflejos incondicionados permiten una adaptación limitada. Son reflejos innatos y constantes que permiten una adaptación relativamente imperfecta del organismo a las condiciones variables de vida. En el recién nacido, se encuentran reflejos de supervivencia, de defensa, de orientación y atávicos.
La formación de reflejos condicionados presupone la formación de conexiones nerviosas temporales. El tiempo de formación depende de la fuerza de los reflejos incondicionados, la estabilidad de la excitabilidad de la corteza cerebral y la existencia de procesos dominantes.
Condiciones Básicas para la Formación de los Reflejos Condicionados
Condiciones básicas para la formación de reflejos condicionados:
- Rapidez de formación depende del estado somático del niño.
- Estado de excitabilidad de los centros subcorticales.
- Corteza cerebral con óptimo estado de excitabilidad.
- Fuerza de los estímulos condicionados no excesiva.
- Estado normal de los analizadores.
- Estimulación simultánea de varios analizadores.
- Consideración de las diferencias individuales.
- Ausencia de estímulos ajenos fuertes.
La actividad principal de la corteza cerebral es la formación de reflejos condicionados (conexiones nerviosas temporales). La formación de un reflejo condicionado implica la selección del estímulo que lo produce. Esta actividad analítico-sintética permite la adaptación a las condiciones de vida.
En el hombre, los estímulos condicionados incluyen la palabra (segundo sistema nervioso central de señales de la realidad).
La Excitación y la Inhibición: Procesos Nerviosos Básicos de la Actividad Nerviosa Superior
La actividad analítico-sintética se realiza mediante los analizadores. Se producen dos procesos: excitación (difusión de la estimulación, actividad del organismo) e inhibición (cese de la estimulación, disminución de la actividad). Hay una relación antagónica, estrechamente interrelacionados.
La excitación es la base fisiológica de la asimilación de conocimientos y habilidades, mientras que la inhibición de su pérdida u olvido.
Movimiento de los Procesos Nerviosos en la Corteza Cerebral
Los procesos de excitación e inhibición se difunden (irradiación) y se concentran. La irradiación juega un papel importante en la formación de conexiones nerviosas temporales (generalización de reflejos condicionados), mientras que la concentración juega un rol en su diferenciación y precisión.
La ley de la inducción mutua establece que la excitación o la inhibición causa o refuerza el proceso contrapuesto.
El Estereotipo Dinámico: Base Fisiológica de la Formación de Hábitos
Los estímulos forman cadenas de estímulos. El cerebro reacciona diferenciando un sistema de otro. La actividad sistematizadora permite formar reflejos condicionados a conjuntos de estímulos y a la relación entre ellos.
El estereotipo dinámico es un conjunto de respuestas ante una serie de estímulos que se presentan de forma estable. Reduce el gasto de energía nerviosa, aminora la fatiga y facilita el aprendizaje de las acciones.
La formación de estereotipos dinámicos es la base fisiológica de la formación de hábitos.
Particularidades de la Actividad Nerviosa Superior en la Infancia
Particularidades de la actividad nerviosa superior en las primeras edades:
- Rápida formación y pérdida de reflejos condicionados y estereotipos dinámicos.
- Aumento progresivo de la capacidad de trabajo del sistema nervioso central.
- Limitada capacidad de resistencia de las células nerviosas.
- Desequilibrio de los procesos de excitación-inhibición (predominio de la excitación).
- Falta de movilidad (labilidad) de los procesos de excitación-inhibición.
- Fácil alteración del estado de excitabilidad de la corteza cerebral.
- Aparición relativamente fácil de la inhibición externa.
- Paulatino desarrollo de la inhibición condicionada interna.
- Influencia mantenida de los segmentos subcorticales del sistema nervioso central sobre la corteza cerebral.
- Poca significación inicial del segundo sistema de señales.
- Progresiva concentración y localización de la actividad motriz.
- Mecanismos de adaptación insuficientemente formados.
Educación Infantil y Actividad Nerviosa Superior
No es posible educar correctamente a los niños sin conocer las particularidades de su actividad nerviosa superior. El conocimiento de estas particularidades permite dirigir de manera más científica el proceso docente-educativo y lograr los objetivos de la educación.
La base fisiológica del fenómeno psíquico, expresada en la actividad nerviosa superior, establece el transcurso fisiológico de este proceso psíquico, su modificación por las condiciones externas, y comprueban la naturaleza fisiológico-funcional de las formaciones de la conducta, que constituyen la premisa y condición del fenómeno psíquico.
El aprendizaje no depende solo de las formas y métodos de enseñanza, sino también de las particularidades del funcionamiento del sistema nervioso central. Conocer estas particularidades permite a los educadores dirigir el proceso educativo de manera más efectiva.
Esto permite comprender mejor al niño, saber por qué en un momento determinado hacen cosas que parecen inexplicables.
Se debe conjugar condiciones externas e internas para un mejor aprendizaje y comportamiento, garantizando el éxito de la labor pedagógica.
El educador no debe convertirse en fisiólogo, pero no puede desconocer las leyes de la actividad nerviosa superior y valorar su interrelación con su trabajo educativo.
Bibliografía
- Gloning, K., & Hoff, H. (1987). Localización cerebral en los trastornos de la actividad nerviosa superior en Neurofisiología contemporánea. Ed. Orbe, La Habana.
- Luria, A. R. Las funciones corticales superiores del hombre. Ed. Orbe, La Habana.
- Morros Sardá, J. (1969). Elementos de fisiología. Ed. Univ. De Madrid.
- Martínez Mendoza, F. (1996). Particularidades de la actividad nerviosa superior y el crecimiento y el desarrollo en niños de 0 a 6 años. Ed. IPLAC, La Habana.
- Vigotski, L. S. (1987). Historia del desarrollo de las funciones psíquicas superiores. Ed. Científico-Técnicas, La Habana.
limite de las áreas presión arterial
http://vitae.ucv.ve/index_pdf.php?module=articulo_pdf&n=4264&rv=97
Localización de la actividad paroxística en pacientes con hipertensión arterial con el uso de la Tomografía Electromagnética de Baja Resolución (LORETA)
Fecha de recepción: 25/10/2010
Fecha de aceptación: 07/12/2010
Por resultados anteriores en hipertensos sin complicaciones clínicas decidimos hacer un análisis mediante la Tomografía Electromagnética de Baja Resolución (LORETA) para determinar las áreas donde se originaban los paroxismos obtenidos en el Electroencefalogama digital (EEGd). 84 pacientes integraron dos grupos de acuerdo con su presión arterial sistólica (PAS) y diastólica (PAD): G1 (PAS=140-159; PAD=90-99), y G2 (PAS≥160; PAD≥100) vs controles sanos. En los EEGd de los pacientes se obtuvieron los paroxismos que se transformaron al sistema LORETA para su localización. Los paroxismos se localizaron principalmente en áreas 17 y 37 de Brodman del hemisferio derecho y en las áreas de 6, 39 y 10 de Brodman del hemisferio izquierdo. Estas localizaciones se corresponden a áreas limítrofes de la circulación cerebral más sensibles a la hipoperfusión cerebral que tiene lugar en la hipertensión arterial.
Palabras Claves:Hipertensión arterial, problema inverso, hipoperfusión cerebral, actividad paroxística, tomografía eléctrica, LORETA, áreas limítrofes.


Title
Localization of paroxysmal activity using Low Resolution Electromagnetic Tomography (LORETA) in patients with High Blood Pressure
Abstract
Based in previous results on patients with High Blood Pressure (HBP), it was decided to use the Low Resolution Electromagnetic Tomography Analysis (LORETA) to map the cerebral areas where paroxysmal EEG activity was originated. 84 patients were divided into two groups: G1 (24 patients, systolic blood pressure (SP)=140-159; diastolic (DP) =90-99), G2 (60 patients, SP ≥160; DP ≥100) and 35 control subjects were studied with LORETA measures derived from their digital EEGs. The generators for the paroxysmal activity were mainly localized on the right Brodmannn´s 17 and 37 areas, and on the left Brodmannn´s 6, 39 and 10 areas. These localizations might be due to deficient cerebral blood flow, as these regions are very sensitive to hypoperfusion caused by arterial hypertension
Key Word
High Blood Pressure, inverse problem, cerebral hypoperfusion, paroxymal activity, electromagnetic tomography, LORETA.
Localización de la actividad paroxística en pacientes con hipertensión arterial con el uso de la Tomografía Electromagnética de Baja Resolución (LORETA)
| | |
|
|  | | |
|  | | Introducción
En estudios electroencefalográficos (EEG) realizados en pacientes con Hipertensión Arterial (HTA) (1) sin complicaciones clínicas neurológicas, se ha descrito la presencia de actividad paroxística focal a predominio de las regiones frontales (1). Otros autores han reportado, en las encefalopatías hipertensivas agudas la aparición de actividad paroxística y lenta en las regiones parieto-occipitales de ambos hemisferios (2). En pacientes con encefalopatía hipertensiva severa (T.A. 300/140) se ha reportado la aparición de actividad paroxística seguida por actividad lenta, lo cual mejora gradualmente después de estabilizar la condición clínica de los pacientes, aunque lo que disminuye es la presencia de los paroxismos y se mantiene la actividad lenta (3). Luego, la actividad paroxística es un elemento de frecuente aparición en el EEG de los pacientes con HTA en diferentes condiciones clínicas. Los paroxismos son grafoelementos transitorios, que no forman parte de la actividad de base del EEG, que se destacan de la misma por su inicio y terminación súbita, que alcanzan generalmente una amplitud destacada. La morfología y duración de los paroxismos es variable, la puntas (spikes) pueden durar entre 20 y 70 mseg y las ondas lentas angulares (sharp waves) pueden durar entre 70 y 200 mseg. Generalmente el componente principal de los paroxismos es negativo (4). Hay diferentes tipos de paroxismos en dependencia de su morfología, su forma de presentación en el EEG, su localización en un grupo de derivaciones o en forma generalizada; si se trata de paroxismos que forman una crisis eléctrica (críticos o ictales) o si no forman parte de una crisis (intercríticos o interictales); si se propagan a partir de su localización original o no. Las características de la actividad paroxística define la significación semiológica de los mismos en la interpretación de los EEGs (5). La localización de los paroxismos en un registro electroencefalográfico de superficie no se corresponde necesariamente con el área donde se está generando esta actividad, esto quiere decir que si en el EEG se observa la actividad paroxística en la derivación parietal derecha, puede estar originándose en otra región de la corteza o de estructuras subcorticales y lo que registramos es su proyección sobre esa área, lo cual depende de la geometría de los generadores y del diseño por circunvoluciones de la corteza cerebral. Esto se ha comprobado por registros intracorticales e intracerebrales y su relación con los correspondientes registros de superficie (6, 7). Por lo tanto, se han desarrollado diferentes métodos para tratar de resolver el Problema Inverso para la actividad paroxística, esto quiere decir, que teniendo el registro del paroxismo en el EEG de superficie se puede determinar en qué punto de los hemisferios cerebrales se originó. El método más eficiente para resolver el Problema Inverso en el caso de los paroxismos es la Tomografía Electromagnética de Baja Resolución (LORETA) (8), que consiste en la estimación de norma mínima generalizada de distribución de generadores que usa más fuentes que electrodos. Utiliza un enrejillado tridimensional de fuentes, discreto, dentro del volumen del encéfalo, con un número considerablemente mayor de fuentes que de electrodos (8, 9). Se escoge una solución única minimizando el Laplaciano de la distribución de corriente con la ponderación de la intensidad del generador. Esto permite calcular soluciones al problema inverso, distribuidas con un grado de suavidad espacial, que según la hipótesis matemática en el operador laplaciano, es que puntos cercanos deben activarse de forma similar. Sin embargo, otros autores (10-12) consideran que dada la distancia entre los puntos del cerebro utilizada en esta implementación, la escala de suavidad del LORETA es realmente diferente de la verdadera escala neural. En su implementación el LORETA hace uso del modelo de las tres esferas concéntricas registradas para el Atlas Cerebral Humano de Talairach (13) disponible como RMN cerebral digitalizada del Brain Imaging Center del Instituto Neurológico de Montreal y se tuvo que ajustar el registro entre la geometría esférica vs. la realista de la cabeza, usando las coordenadas 10-20 y 10-10 para los electrodos del EEG (14). La solución inversa está restringida a la sustancia gris cortical y al hipocampo, como se determinó con la digitalización del Atlas Probabilístico también disponible en el Brain Imaging Center del Instituto Neurológico de Montreal, con corrección al espacio de Talairach (15). Las áreas de Brodmannn también se reportan. El volumen intracerebral se divide en 6239 voxels con 5 mm de resolución espacial. Un voxel se marca como sustancia gris si cumple las siguientes tres condiciones: 1) Su probabilidad de ser sustancia gris es mayor que la de ser sustancia blanca, 2) su probabilidad de ser sustancia gris es mayor que la de ser LCR, 3) su probabilidad de ser sustancia gris es mayor del 33 %. Sólo los voxels que pertenecen a la corteza y al hipocampo son usados para el análisis. Un total de 2394 voxels con 7 mm de resolución espacial se producen bajo estas restricciones neuroanatómicas (8, 9). Estas premisas restringen enormemente la detección de posibles fuentes subcorticales en la sustancia blanca, de origen de densidad eléctrica, cuando se le aplican estas restricciones para su consideración como fuente. Un software (datos y ejecutable) implementando LORETA en el espacio de Talairach está a disposición de la comunidad científica en Internet, en la página Web del KEY Institute for Brain Mind Research de Zurich, Suiza, (http:www.z.ch/keyinst/loreta.htm) para calcular la distribución tridimensional de la densidad de corriente en la corteza cerebral, lo cual produjo una utilización amplia de este método con muchos partidarios y algunos detractores (9). El LORETA-S es un método estandarizado, discreto, tridimensional (3D), lineal, para obtener la solución inversa. La forma de estandarización utilizada en LORETA-S permite la localización tomográfica exacta para examinar las fuentes, produciendo imágenes de densidad de corriente con localización exacta, aunque con baja resolución espacial: las fuentes neuronales vecinas pueden estar altamente correlacionadas (8). Las pruebas de su exactitud matemática se describen en las referencias al respecto hechas por el autor (8, 16, 17). Es importante destacar que LORETAs no tiene distorsión en su localización aún en presencia de ruido biológico. En este sentido LORETA-S superó a las primeras versiones de este método (8). Se debe enfatizar que las propiedades de localización de cualquier solución inversa 3D (ej. Tomografía) pueden ser siempre determinadas por errores de localización para examinar puntos de fuente. Si dicha tomografía tiene cero error de localización para dichos puntos de fuentes (16), la localización en cualquier parte del cerebro entonces, excepto por la baja resolución espacial, se localizará correctamente en cualquier distribución 3D arbitraria. Esto es debido a los principios de linealidad y superposición. Estos principios no se aplican a soluciones inversas no lineales, ni se aplican a esquemas que parezcan lineales pero no lo sean, como por ejemplo los ajustes de dipolos. LORETA ha sido combinada con estudios de Resonancia Magnética funcional (RMNf) y estructural, Tomografía de Emisión de positrones, implantación de electrodos profundos en epilepsia y potenciales evocados cognitivos (8, 18-21)con una adecuada validación de su exactitud en localización. En el caso de la versión estandarizada LORETAs, estructuras profundas como la corteza cingulada anterior y la corteza Mesial temporal pueden ser correctamente localizadas (22). En múltiples estudios en los que se han realizado comparaciones con localización en RMN, registros con electrodos intracorticales, estudios con técnicas neuropsicológicas, se ha visto que LORETA determina correctamente la localización de los generadores y su autor hace una extensa revisión de esos logros (9, 23). La principal crítica a LORETA es la suavidad de las soluciones, lo cual localiza las fuentes puntuales con mucha dispersión. Esto es inherente a que se utiliza al Operador Laplaciano Superficial (24) para la estimación de los generadores. Sin embargo, la utilización de LORETA para la localización del origen de los paroxismos ha sido validada con la utilización de electrodos colocados directamente en la corteza, intracorticales y subcorticales, durante intervenciones quirúrgicas en las cuales la localización determinada por LORETA se ha validado con la localización intracraneal (21). Por esto decidimos utilizar LORETA como un método para confirmar el origen de la actividad paroxística de nuestros pacientes.
| | |
|
|  | | |
|  | | Materiales y métodos
Se hizo un corte transversal, descriptivo de una muestra de pacientes tomadas por tres expertos en el área. Se estudiaron 84 pacientes con HTA que fueron clasificados por tres especialistas en Medicina Interna en dos grupos, de acuerdo con las normas del VII Reporte del Comité Conjunto Nacional sobre la Prevención, Evaluación y Tratamiento de la Hipertensión Arterial (25), en:
Grupo 1 (PAS=140-159 y PAD=90-99) n=24 pacientes, (14 mujeres, edad media 49±4 años)
Grupo 2 (PAS≥160 y PAD≥100) n=60 pacientes, (31 mujeres, edad media 50±6 años).
Todos los pacientes estaban controlados de su HTA con tratamiento (que en todos los casos fueron IECAs ó ARA II) y no presentaron signos electrocardiográficos de hipertrofia ventricular izquierda. Los criterios de inclusión en el estudio fueron los siguientes: 1. No tener elementos clínicos sugestivos de una Encefalopatía Vascular Hipertensiva aguda ni crónica. 2. No haber sido nunca paciente de un servicio de Neurología y/o Psiquiatría. 3. No tomar medicamentos anticonvulsivantes ni que afecten al Sistema Nervioso. 4. No tener una enfermedad sistémica diferente de la HTA. 5. No haber tenido fracturas de cráneo ni conmoción cerebral. 6. No estar embarazada o lactando. 7. No ser drogadicto ni alcohólico. Además, se estudió un grupo de sujetos funcionalmente sanos (n=35) (17 mujeres, edad media 47±9 años).
Los sujetos controles no presentaron antecedentes de enfermedades sistémicas, neurológicas ni psiquiátricas, intervenciones neuroquirúrgicas, traumatismos cráneo-encefálicos ni antecedentes de dependencia a drogas y alcohol y realizaron las mismas pruebas que los pacientes. Ninguna mujer estuvo menstruando o embarazada en el momento de realizarse el estudio. Todos los sujetos de este estudio tenían, al menos, octavo grado de escolaridad.
El registro electroencefalogáfico (EEG) se realizó en vigilia, con los ojos cerrados, en un ambiente con luz natural,en un montaje monopolar utilizando como referencia ambas orejas cortocircuitadas en el panel de electrodos. La frecuencia de muestreo del EEG fue de 200 Hz (5 mseg) con un pasabanda entre 0.5 y 30 Hz. Para la adquisición del EEG se colocaron electrodos de disco de oro con pasta conductora en cada una de las derivaciones del Sistema Internacional 10-20 (26) incluyendo la posición Oz, con una impedancia menor de 5 kohms. Los movimientos oculares se registraron colocando un electrodo 1 cm por encima y por fuera del canto externo del ojo izquierdo y otro electrodo 1 cm por debajo y por fuera del canto externo del ojo derecho, para poder eliminar los segmentos del registro con movimientos oculares. El ECG se grabó durante todo el estudio. El paciente se mantuvo sentado, en una poltrona reclinable, durante el tiempo del registro. Se utilizaron como maniobras de activación la apertura y cierre de los ojos, la Hiperventilación Pulmonar (HVP) durante 3 minutos y la fotoestimulación intermitente a distintas frecuencias. Los pacientes estaban normotensos en el momento del registro.
En el análisis de la actividad paroxística se aplicó la Tomografía Electromagnética de Baja Resolución (LORETA) para determinar el área cortical de origen de la actividad paroxística, para lo cual se utilizó el software LORETA-S del Brain Research Institute de Zurich, Suiza, desarrollado para tales propósitos. Para esto se tomaron los segmentos de EEG de cada paciente en la localización donde había un paroxismo detectado visualmente por el electroencefalografista y se “cortaba” el EEG 250 mseg antes y después del inicio y final del paroxismo, en un segmento de EEG que comprendía todas las derivaciones del Sistema Internacional 10-20 incluyendo Oz. Estos segmentos se transformaban a ficheros de texto y después a ficheros lor con el sistema LORETA-S, con el cual se hacía el procesamiento para determinar el origen del paroxismo. En la figura 1 se presenta la imagen tomográfica de LORETA que es solamente de tipo ilustrativa, porque el resultado es un fichero texto donde se dan las coordenadas en los tres ejes (x,y,z) del espacio de Talairach donde se localiza el origen del paroxismo, el área de Brodmann donde está este punto y la circunvolución cerebral a que pertenece. Se cuantificaron las localizaciones que determinaba el LORETA-S según el área de Brodmann y el hemisferio cerebral y se hizo un análisis de Chi cuadrado entre los grupos de pacientes. Los sujetos sanos no presentaron actividad paroxística en el EEG. El nivel de significación estadística se tomó para un valor de p
| | |
|
|  | | |
|  | | Resultados

Figura 1: Imagen de Tomografía Electromagnética de Baja Resolución (LORETA) donde se representa la localización en el área 17 de Brodman en un paciente del grupo HTA 1. Con esta técnica se encontró que en ambos grupos de pacientes hipertensos los paroxismos se originan principalmente en: 1) el área 17 de Brodmann del hemisferio derecho en la porción más central del cuneus, en la cara medial de los hemisferios (figura 1); 2) en el área 39 de Brodmann del hemisferio izquierdo, en la parte de la circunvolución temporal medial; 3) en el área 37 de Brodmann del hemisferio derecho, en la circunvolución temporal medial; 4) en el área 6 de Brodmann del hemisferio izquierdo (más marcado para los pacientes del grupo HTA 2), en la circunvolución frontal medial y 5) en el área 10 de Brodmann del hemisferio izquierdo en la circunvolución frontal medial (sólo para el grupo HTA 1). (figura 2)
Figura 2: Areas de Brodmann donde se localizaron los orígenes de los generadores de la actividad paroxística. Se determinó entonces la irrigación de estas áreas de acuerdo con las normas de Duvernoy (27, 28) para humanos y se pudo apreciar que: 1) El área 17 de Brodmann, en la porción más central del cuneus en la cara medial de los hemisferios, es un área limítrofe (interterritorial) entre la rama leptomeníngea de la Arteria Cerebral Anterior (ACA) y la rama leptomeníngea de la Arteria Cerebral Posterior (ACP). 2) El área 39 de Brodmann, en la parte de la circunvolución temporal medial, es un área limítrofe (interterritorial) entre la rama leptomeníngea de la Arteria Cerebral Media (ACM) y la rama leptomeníngea de la Arteria Cerebral Posterior (ACP). 3) El área 37 de Brodmann, en la circunvolución temporal medial, es un área limítrofe (interterritorial) entre las ramas perforantes de la Arteria Cerebral Media (ACM) y la rama leptomeníngea de la Arteria Cerebral Posterior (ACP). 4) El área 6 de Brodmann, en la circunvolución frontal medial, es un área limítrofe (interterritorial) entre la rama leptomeníngea de la Arteria Cerebral Media y la rama leptomeníngea de la Arteria Cerebral Anterior. 5) El área 10 de Brodmann, en la circunvolución frontal medial, es un área limítrofe (interterritorial) entre la rama leptomeníngea de la Arteria Cerebral Media (ACM) y la rama leptomeníngea de la Arteria Cerebral Anterior (ACA).
| | |
|
|  | | |
|  | | Discusión
Actualmente el método más exacto de localización del lugar de origen de la actividad paroxística es la Tomografía Electromagnética de Baja Resolución (LORETA), método que ha sido validado comparando sus resultados con la localización intracerebral con electrodos implantados intracorticalmente (8,9,17,18,21). La localización que fundamentalmente se determinó con este método correspondió a regiones de la corteza cerebral que son áreas limítrofes entre dos arterias y particularmente entre dos ramas distales de dos de las arterias cerebrales principales: 1) El área 17 de Brodmann, en la porción más central del cuneus en la cara medial de los hemisferios, es un área limítrofe entre la rama leptomeníngea de la ACA y la rama leptomeníngea de la ACP. 2) El área 39 de Brodmann, en la parte de la circunvolución temporal medial, es un área limítrofe entre la rama leptomeníngea de la ACM y la rama leptomeníngea de la ACP. 3) El área 37 de Brodmann, en la circunvolución temporal medial, es un área limítrofe entre las ramas perforantes de la ACM y la rama leptomeníngea de la ACP. 4) El área 6 de Brodmann, en la circunvolución frontal medial, es un área limítrofe entre la rama leptomeníngea de la ACM y la rama leptomeníngea de la ACA. 5) El área 10 de Brodmann, en la circunvolución frontal medial, es un área limítrofe entre la rama leptomeníngea de la ACM y la rama leptomeníngea de la ACM. El área 6 de Brodmann en la circunvolución frontal medial (CFM) está más afectada para el grupo HTA 2 (Fig 2) porque este grupo tiene valores de presión arterial más elevados y por tanto el stress de pared es mayor, lo cual determina una mayor hipoperfusión. La CFM ha sido descrita como un área de origen de generadores de actividad lenta en pacientes con HTA (29) utilizando la Tomografía Eléctrica de Resolución Variable (VARETA), estando más comprometida en los pacientes hipertensos del grupo 2. La CMF es un territorio limítrofe muy sensible a la hipoperfusión que se asocia a la HTA. Las áreas distales siempre son afectadas por la hipoperfusión, por la marcada reducción de la presión hidrostática en los capilares que disminuye la presión neta de filtración hacia los tejidos, pero las áreas limítrofes están entre dos territorios distales y dependen de la difusión tisular desde los capilares de las ramas distales, con lo cual son las áreas más afectadas ante un evento de hipoperfusión como el que se produce en el vasoespasmo arterial y arteriolar cuando la presión arterial está elevada en los pacientes con HTA. Además, se ha reportado que las marcadas oscilaciones en el stress de pared durante el ciclo cardíaco pueden acelerar el proceso ateroesclerótico en las zonas más distales de la circulación carotídea (30). El incremento en la excitabilidad en la corteza cerebral se produce como consecuencia de la reducción del Flujo Sanguíneo Cerebral (FSC) sin isquemia (31). Estos factores determinan que en estas áreas se incremente la excitabilidad que es registrada en el EEG como actividad paroxística. Cualquier grafoelemento que se registre en la superficie requiere de la activación entre 4 y 20 cm2 de corteza (32, 33), pero esta área tiene determinadas características no sólo por la hipoperfusión, sino porque la descarga sincrónica de grandes grupos neuronales que se produce en forma repetitiva, que produce paroxismos intercríticos o interictales y que se mantiene en el tiempo, induce alteraciones en el tejido nervioso que han sido muy estudiadas. Utilizando técnicas de Espectroscopía de Resonancia Magnética, se ha encontrado que en las áreas donde se localiza la actividad paroxística interictal hay disminución de NAA (compuestos N-acetil) sin pérdida neuronal, lo cual se relaciona con stress oxidativo a nivel neuronal (30). Otro estudio (34) demostró stress oxidativo en áreas de generación de paroxismos, con altos niveles de lactato, en la Resonancia Magnética Cerebral de corteza occipital normal en pacientes con paroxismos fotosensibles. Se ha observado que la recuperación de los niveles de NAA en los focos paroxísticos está relacionada con la recuperación de la función mitocondrial y la resolución del stress oxidativo(34). En adición al stress oxidativo, puede haber cambios estructurales ligeros, como es la reducción de las ramificaciones dendríticas, que también pueden contribuir a la disminución del NAA (35). Por otra parte, se ha demostrado que en las zonas donde se origina la actividad paroxística intercrítica, hay hipometabolismo e hipoperfusión que se extiende más allá del área de origen de los paroxismos (37-43). Esto se ha postulado que está asociado a alteraciones funcionales y no estructurales del tejido nervioso (37, 38). Por lo tanto, la condición de generación de actividad paroxística en el tejido nervioso está asociada con alteraciones metabólicas y hemodinámicas que se pueden incrementar si los paroxismos se originan como consecuencia de la hipoperfusión crónica de un área cortical, en nuestro caso por el vasoespasmo producido por la HTA. Conclusiones: 1.- Con la Tomografía Eléctrica de Baja Resolución (LORETA) los generadores de actividad paroxística en los pacientes hipertensos se localizaron en las áreas 17 y 37 de Brodmann del hemisferio derecho, 39, 6 y 10 de Brodmann a predominio del hemisferio izquierdo. 2.- La actividad paroxística del electroencefalograma del paciente con Hipertensión Arterial se origina principalmente en áreas limítrofes de irrigación de las arterias cerebrales. 2.- Técnicas como la Tomografía Eléctrica de Baja Resolución (LORETA) son útiles para el estudio neurofisiológico del paciente con factores de riesgo para desarrollar Encefalopatías Vasculares. Este trabajo fue financiado por: Fondo Nacional de Ciencia y Tecnología (FONACIT) Proyecto S1-97000758. y por el Consejo de Desarrollo Científico y Humanístico (CDCH) Proyecto 09.11.5494.2004
| | |
|
|  | | |
|  | | Referencias
1.- De Quesada-Martínez ME, Blanco-García M, Díaz-De Quesada L. Alteraciones funcionales cerebrales tempranas en pacientes con hipertensión arterial no complicada. Rev Neurol 2005; 40(4): 199-209. 2.- Aguglia U, Tinuper P, Farnarier G, Quattrone A. Electroencephalographic and anatomo-clinical evidences of posterior cerebral damage to hypertensive encephalopathy. Clin. Electroencephalogr. 1984. 15. 53-60. 3.- Benna P, Bergamini L, Tarenz L, Troni W, Pinessi L. Hypertensive encephalopathy: association with unusual EEG Changes. Electroencephalogr. Clin. Neurophysiol. 1984; 102: 538-557. 4.- IFSECN, 1974. A glossary of terms commonly used by clinical electroencephalographers. Electroencephalogr. Clin. Neurophysiol. 37:538-548. 5.- Niedermeyer E, Abnormal EEG Patterns: Epileptic and Paroxysmal. Cap 13: 255-279 En: Electroencephalography. Basic Principles, Clinical Applications, and Related Fields. Editors: Niedermeyer, Ernst; da Silva, Fernando Lopes. 5th Edition, 2005 Lippincott Williams & Wilkins. 6.- Niedermeyer E. Depth Electroencephalography. Cap 36: 734-749 En: Electroencephalography. Basic Principles, Clinical Applications, and Related Fields. Editors: Niedermeyer, Ernst; da Silva, Fernando Lopes. 5th Edition, 2005 Lippincott Williams & Wilkins. 7.- Baumgartner C. EEG dipole localization: discussion. Acta Neurol. Scand. Suppl. 1994; 152:31-32. 8.- Pascual-Marqui RD, Michel CM, Lehmann D. Low Resolution Electromagnetic Tomography: A New Method for Localizing Electrical Activity in the Brain, Int. J. Psychophysiol., Vol. 18, 1994, pp. 49-65. 9.- Pascual-Marqui RD, Esslen M, Kochi K, Lehman D. Functional imaging with low resolution brain electromagnetic tomography (LORETA). Review, new comparisons, and new validation. Japanese Journal of Clinical Neurophysiology. 2002; 30:81-94. 10.- Fuchs M, Wischmann HA, Wagner M. Generalized minimum norm least squares reconstruction algorithms. ISBET Newsletter 1994: 5: 8-11. 11.- Hämäläinen M. Discrete and distributed source estimates. ISBET Newsletter 1995; 6: 9-12. 12.- Grave de Peralta-Menéndez R, González SL. Discussing the capabilities of laplacian minimization. Brain Topogr 2000; 13: 97-104. 13.- Talairach J, Tournoux P. Co-Planar Stereotaxic Atlas of the Human Brain. 1988. Thieme, Stuttgart. 14.- Towle VL, Bolanos J, Suarez D, Tan K, Grzeszczuk R, Levin DN, Cakmur R, Frank SA, Spire JP: The spatial location of EEG electrodes: locating the best-fitting sphere relative to cortical anatomy. Electroencephalography and Clinical Neurophysiology 1993; 86, 1-6. 15.- Brett M, Johnsrude IS, Owen AM. The problem of functional localization in the human brain. Nature Reviews Neuroscience. 2002;3(3):243-249. 16.- Pascual-Marqui RD. “Discrete, 3D Distributed, Linear Imaging Methods of Electric Neuronal Activity. Part 1: Exact, Zero Error Localization,” arXiv:0710.3341 [math-ph], October 17, 2007, http://arxiv.org/abs/0710.3341 17.- Pascual-Marqui RD. Theory of the EEG Inverse Problem, Chapter 5, pp: 121-140. In: Quantitative EEG Analysis: Methods and Clinical Applications, Eds: S. Tong and N.V. Thakor; 2009. Artech House, Boston 18.- Seeck M, Lazeyras F, Michel CM, Blanke O, Gericke CA, Ives J, Delavelle J, Golay X, Haenggeli CA, De Tribolet N, Landis T: Non-invasive epileptic focus localization using EEG-triggered functional MRI and electromagnetic tomography. Electroencephalography and Clinical Neurophysiology 1998;106: 508-512, 19.- Worrell GA, Lagerlund TD, Sharbrough FW, Brinkmann BH, Busacker NE, Cicora KM, O'Brien TJ: Localization of the epileptic focus by low-resolution electromagnetic tomography in patients with a lesion demonstrated by MRI. Brain Topography 2000; 12: 273-282. 20.- Dierks T, Jelic V, Pascual-Marqui RD, Wahlund LO, Julin P, Linden DEJ, Maurer K, Winblad B, Nordberg A: Spatial pattern of cerebral glucose metabolism (PET) correlates with localization of intracerebral EEG-generators in Alzheimer's disease. Clinical Neurophysiology. 2000; 111: 1817-1824. 21.- Lantz G, Michel CM, Pascual-Marqui RD, Spinelli L, Seeck M, Seri S, Landis T, Rosen I: Extracranial localization of intracranial interictal epileptiform activity using LORETA (low resolution electromagnetic tomography). Electroencephalography and Clinical Neurophysiology 1997. 102: 414-422, 22.- Pizzagalli D, Pascual-Marqui RD, Nitschke JB, Oakes TR, Larson CL, Abercrombie HC, Schaefer SM, Koger JV, Benca RM, Davidson RJ: Anterior cingulate activity as a predictor of degree of treatment response in major depression: evidence from brain electrical tomography analysis. American Journal of Psychiatry 2001;158:405-415. 23.- Pascual-Marqui RD. Reply to Comments Made by R. Grave De Peralta Menendez and S.I. Gonzalez Andino. International Journal of Bioelectromagnetism 1999, Vol. 1, No. 2, 24.- Pascual, R. D, González, A. S. L. Valdés, P, Valdés, M. Current source density estimation and interpolation based on the spherical harmonic expansion. 1988. Int J. Neurosci. 43: 237-250. 25.- Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003; 289(19): 2560-72. 26.- Jasper H. Report of committee on methods of clinical exam in EEG. Electroencephalogr clin. Neurophysiol. 1958;10:370-375. 27.- Van der Zwan A, Hillen B, Tulleken CAF, Dujovny M, Dajovic L.Variability of the territories of the major cerebral arteries. J Neurosurg 1992; 77:927-940. 28.- Duvernoy HM. The Human Brain Surface, Blood Supply, and Three-Dimensional Sectional Anatomy. 2nd completely rev. and enl. Ed. Springer-Verlag Wien New York. 1999. 29.- Quesada-Martínez ME, Reyes-Moreno M, Franco-Ricart C. Signos de disfunción frontal en pacientes con Hipertensión Arterial no complicada. VITAE. Academia Biomédica Digital. Enero-Marzo 2009 N°37 ISSN 1317-987X 30.- Ku DN, Giddens DP, Zarins Glagov S, Pulsatile flow and atherosclerosis in the human carotid bifurcation: positive correlation between plaque location and low oscillating shear stress. 1985. Ateriosclerosis. 5:293-302. 31.- Lipton P. Ischemic Cell Death in Brain Neurons. Physiological Reviews. 1999. Vol. 79. No. 4 pp. 1431-1568. 32.- John ER, Prichep LS. Principles of Neurometric Analysis of EEG and Evoked Potentials. En: Electroencephalography: Basic Principles, Clinical Applications, and Related Fields. 1993; Chap. 55. 3rd Ed. Eds. E. Niedermeyer and F. Lopes Da Silva. Lippincott Williams & Wilkins. 33.- Hämäläinen MS, Hari R, Ilmoniemi RJ, Knuutila J, Lounasmaa OV: Magnetoencephalography - theory, instrumentation, and applications to noninvasive studies of the working human brain. Rev. Mod. Phys. 199365: 413–497. 34.- Chiappa KH, Hill RA, Huang-Hellinger F et al. Photosensitive epilepsy studied by functional magnetic resonance imaging and magnetic resonance spectroscopy. Epilepsia. 1999; 40(suppl 4):3-7. 35.- Kamada K, Takeuchi F, Houkin K, et als. Reversible brain dysfunction in MELAS: MEG, and (1)H MRS analysis. J Neurol Neurosurg Psychiatry. 2001; 70:675-678. 36.- Multani P, Myers RH, Blume HW. Neocortical dendritic pathology in human partial epilepsy: a quantitative Golgi study. Epilepsia. 1994; 35:728-736. 37.- Sakamoto S, Tsuyuguchi N, Takami T, Morino M, et als. Interictal Patterns of Cerebral Glucose Metabolism, Perfusion. and Magnetic Field in Mesial Temporal Lobe Epilepsy. Epilepsia, 2003; 44(9):1196-1206. 38- Matheja P, Kuwert T, Stodieck SR et al. PET and SPECT in medically non refractory complex partial seizures. Nuklearrmedizin. 1998;37:221-226. 39.- Grunwald F, Menzel C, Pavics L et als. Ictal and interictal brain SPECT imaging in epilepsy using technetium-99m-ECD. J.Nucl Med 1994;35:1896-1901. 40.- O´Brien TJ, Newton MR, Cook MJ et al. Hippocampal atrophy is not a major determinant of regional hipometabolismo in temporal lobe epilepsy. Epilepsia. 1997;38:74-80. 41.- Henry TR, Mazziotta JC, Engel J Jr. Interictal metabolic anatomy of mesial temporal lobe epilepsy. Arch Neurol 1993;50:592-589. 42.- Sackellares JC, Siegel GJ, Abou-Khalil BW, et al. Differences between lateral and mesial temporal hypometabolissm interictally in epilepsy of the mesial temporal origin. Neurology. 1990;40:1420-1426. 43- Henry TR, Mazziotta JC, Engel J Jr, et al. Quantifying interictal metabolic activity in human temporal lobe epilepsy. J Cereb Blood Flow Metab. 1990;10:748-757. |
|
visual
Desde el punto de vista de la organización
cortical, se han propuesto las áreas 6,19, 40 y 47
de Brodman, principalmente del hemisferio derecho, como sustrato cortical de estos dispositivos. Por otra parte, está bien establecido que
vías diferentes: “ventral” vs. “dorsal”, sirven al
procesamiento de información con estos contenidos y se encuentran segregadas aparentemente, desde la retina hasta la corteza prefrontal,
aunque con un alto grado de interconexión
 español con un tamaño de 76,37 KB
español con un tamaño de 76,37 KB













