Estados de Agregación de la Materia y Estructura Atómica: Conceptos Fundamentales
Enviado por Chuletator online y clasificado en Química
Escrito el en  español con un tamaño de 5,89 KB
español con un tamaño de 5,89 KB
1. Estados de Agregación de la Materia
La materia se presenta en cuatro estados de agregación principales:
- Sólido
- Líquido
- Gas
- Plasma
2. Tabla Comparativa de los Estados de Agregación
A continuación, se presenta una descripción de las características de cada estado de agregación:
- Sólido: Las partículas están fuertemente unidas, manteniendo un volumen definido y alta resistencia. No se puede atravesar fácilmente y presenta alta dureza. Las partículas vibran en posiciones fijas.
- Líquido: Las partículas están juntas pero con mayor libertad de movimiento que en los sólidos. Adopta la forma del recipiente que lo contiene, manteniendo un volumen definido. Se puede atravesar y las partículas vibran y se desplazan. Presenta presión.
- Gaseoso: Las partículas están muy separadas y se mueven libremente, lo que resulta en un volumen indefinido. Se expande y ocupa todo el espacio disponible. Se puede atravesar fácilmente y tiene menor densidad que los sólidos y líquidos.
3. Modelo Atómico Actual
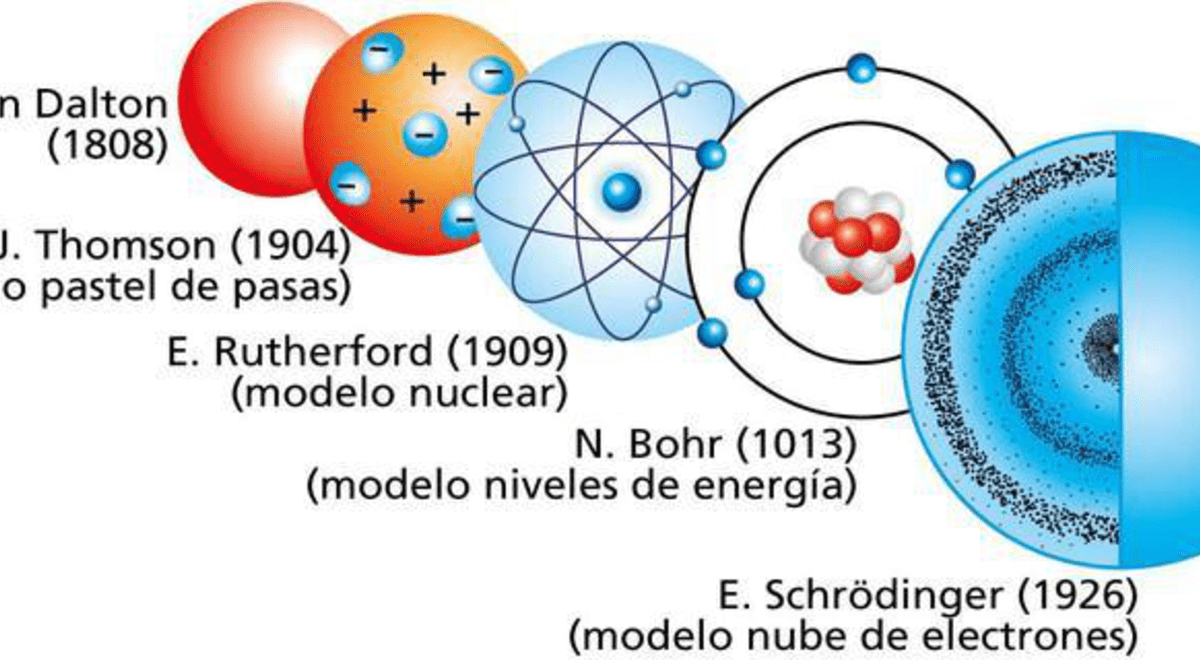
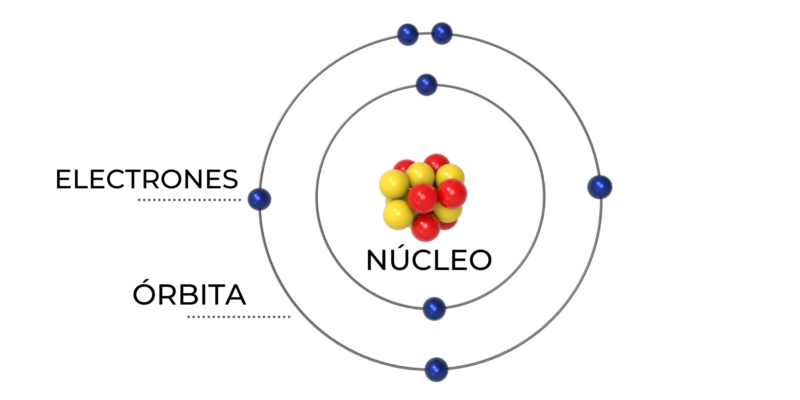
El modelo atómico actual, también conocido como modelo cuántico del átomo, se basa en las ideas de varios científicos, pero la contribución principal se atribuye a Niels Bohr (1913).
4. Objeto de Estudio de la Química
La Química estudia la materia, la energía y los cambios que experimentan.
5. Definición de Materia
La materia es todo aquello que ocupa espacio y tiene masa. Está formada por átomos, que a su vez consisten en protones, neutrones y electrones.
6. Partículas Subatómicas (Según la IUPAC)
Las partículas subatómicas principales son:
- Protones
- Neutrones
- Electrones
7. Definición de Átomo
Un átomo es la unidad más pequeña de la materia que mantiene las propiedades químicas de un elemento. No puede descomponerse químicamente en sustancias más simples.
8. Objeto de Estudio de la Nanotecnología
La nanotecnología se dedica a la manipulación de la materia a escala casi atómica (nanométrica) para crear nuevas estructuras, materiales y dispositivos.
9. Aplicaciones de la Química en la Medicina
Las propiedades de algunos materiales, estudiadas y desarrolladas por la química, son idóneas para mejorar el diagnóstico y tratamiento de enfermedades.
10. Cambios de Estado de Agregación
Los cambios de estado se clasifican en:
- Cambios Progresivos: Implican un incremento de la energía cinética de las partículas (por ejemplo, fusión, evaporación, sublimación).
- Cambios Regresivos: Suponen un descenso de la energía cinética de las partículas (por ejemplo, solidificación, condensación, sublimación inversa).
11. Factores Externos que Influyen en los Cambios de Estado
- Aumento de Temperatura: Favorece los cambios progresivos.
- Disminución de Temperatura: Favorece los cambios regresivos. La disminución de temperatura causa que un gas pase a estado líquido (condensación) o que un vapor pase directamente a sólido (sublimación inversa).
12. Definición de Fuerza de Cohesión
La fuerza de cohesión es la fuerza que atrae y mantiene unidas a las moléculas de una sustancia.
13. Organización de la Tabla Periódica
La tabla periódica se organiza en:
- 7 filas horizontales llamadas periodos.
- Columnas verticales llamadas grupos o familias.
14. Grupos o Familias de la Tabla Periódica
La tabla periódica se divide en los siguientes grupos principales:
- Metales
- No metales
- Metaloides
- Gases nobles
- Tierras raras (lantánidos y actínidos)
15. Periodos de la Tabla Periódica
La tabla periódica tiene 7 periodos, que se designan numéricamente del 1 al 7. (Las letras k, l, h, n, o, p, q son una nomenclatura antigua para los niveles de energía de los electrones, no para los periodos).
16. Cálculo de Protones, Neutrones y Electrones
Ejemplo con el Cloro:
| Nombre | Símbolo | Número Atómico (Z) | Número de Masa (A) | Protones (p+) | Electrones (e-) | Neutrones (n = A - p+) |
|---|---|---|---|---|---|---|
| Cloro | Cl | 17 | 35 | 17 | 17 | 18 |
17. Estructura de la Tabla Periódica

(Se debe incluir una imagen de la tabla periódica con sus partes señaladas)
18. Ejemplos de Mezclas Homogéneas y Heterogéneas
- Mezclas Heterogéneas:
- Ensalada
- Chocolate con pasas
- Combinación de diferentes tipos de nueces
- Leche con cereal
- Pan con pasas
- Mezclas Homogéneas:
- Gas natural
- Vino
- Leche con chocolate (bien disuelto)
- Agua embotellada (sin sedimentos)
- Masa (de una torta, por ejemplo, bien mezclada)
19. Diagrama de los Contribuyentes al Modelo Atómico